压强/MPa | 温度/℃ | 催化剂 | 平衡时氨的体积分数 | |
能斯特方案 | 5 | 685 | 铂粉 | 0.96% |
哈伯方案 | 20 | 550 | 铀 | 8.25% |
现代方案 | 20 | 500 | 铁催化剂 | 19.1% |
选项 | 事实 | 解释 |
A | 合成氨选择铁触媒做催化剂 | 铁触媒能提高反应的活化能 |
B | 用醋酸能除去水垢中的 | 醋酸的酸性强于碳酸 |
C | 用 |
|
D | 用 | 胃液中的 |


针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
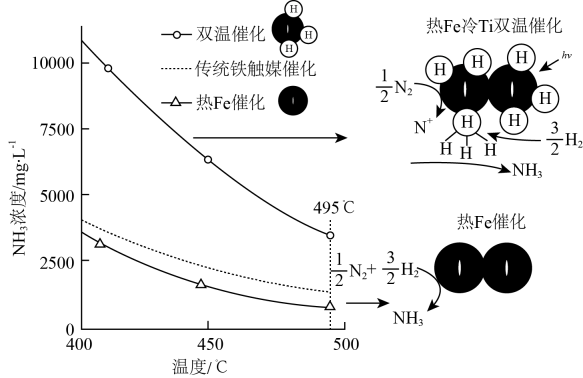
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率

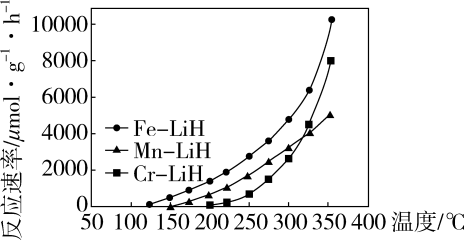
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
实验 | ||||
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率


①0~时间段内,用
表示的反应速率
(用含
的代数式表示)。
②反应进行到时,下列各项能表明反应达到化学平衡状态的是(填字母序号)。
A.容器中气体的密度不变
B.容器中气体的压强不变
C.氨气的百分含量不变
D.消耗3mol的同时生成

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是(写化学式)。
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是。
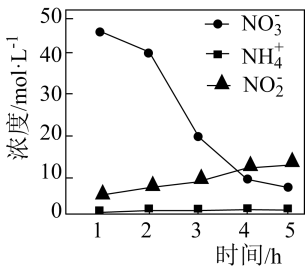
①Fe去除水中的NO 的机理:NO
得到纳米铁粉失去的电子转化为NO
, 极少量NO
在纳米铁粉或Cu表面得到电子转化为NH
。与不添加少量铜粉相比,添加少量铜粉时去除NO
效率更高,主要原因是。
②与初始溶液中NO浓度相比,反应后溶液中所有含氮物质(NO
、NO
、NH
)总浓度减小,原因是。

①流程中,有利于提高原料利用率的措施是;有利于提高单位时间内氨的产率的措施有。
②干燥净化中,有一步操作是用铜氨液除去原料气中的CO,其反应为:。对吸收CO后的铜氨废液应该怎样处理?请提出你的建议:。

①曲线a对应的温度是。
②M、N、Q点平衡常数K的大小关系是。
已知键键能为
,
键键能为
,
键键能为
。若有
完全转化为
, 理论上(选填"放出"或"吸收")
热量。
压强 温度℃ | ||||||
①当合成氨反应达到平衡状态时,若再升高温度,v(正)(填“增大”“不变”“减小”,下同),v(逆)。
②结合实际,请分析为什么工业合成氨压强通常控制在而不是选择更大的压强?。

内,
的平均反应速率是
。
①用表示的化学反应速率为
②一定条件下,能说明该反应进行到最大限度的是。
a.的转化率达到最大值
b.、
和
的分子数之比为
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变


①电极c是(填“正极”或“负极”),电极d的电极反应式为。
②若线路中转移1mol电子,则该燃料电池理论上消耗的在标准状况下的体积为L。
|
化学键 |
H-H |
N≡N |
N-H |
|
断开1mol键所吸收的能量 |
436 kJ |
946 kJ |
391 kJ |

①其中,右室电极为燃料电池的极,电池工作时电路中每转移0.3 mol电子,标准状况下消耗N2的体积是。
②相比现有工业合成氨,该方法有哪些优点(任写两条)。

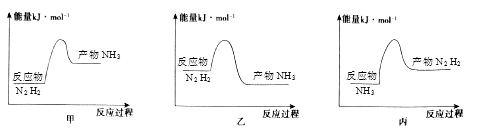
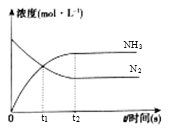
①t1时生成NH3的物质的量是;用H2表示的化学反应速率υ(H2)=。
②下列各项能表明反应达到化学平衡状态的是。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH-H键同时形成6molN-H键
A.使用高效催化剂
B.恒温恒容再充入氢气
C.降低反应温度
D.扩大容器体积