





组别 | c(HCl)(mol•L﹣1) | 温度(℃) | 状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 块状 |
C | 2.5 | 50 | 粉末状 |
D | 2.5 | 50 | 块状 |










①
②
③
计算热分解反应④
的
。

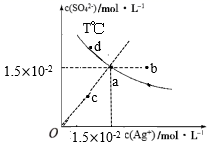
①越小,
平衡转化率,理由是。
②对应图中曲线,计算其在
之间,
分压的平均变化率为
。
反应Ⅰ: ![]() +CH3OH
+CH3OH
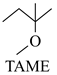 △H1
△H1
反应Ⅱ: ![]() +CH3OH
+CH3OH
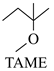 △H2
△H2
反应Ⅲ: ![]()
![]() △H3
△H3
回答下列问题:
A.<-1 B.-1~0 C.0~1 D.>1
H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1
HF(aq)F-(aq)+H+(aq) ΔH=akJ·mol-1
①a=。
②下列说法正确的是。
A.弱酸电离整个过程一定是吸热过程
B.弱酸溶液的温度升高,电离度可能减小
C.加水稀释,有利于弱酸的电离
D.弱酸电离的热效应只与酸性强弱有关


离子 | SO | SO | NO | NO | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式:。增加压强,NO的转化率(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”“不变”或“减小”)。
②反应ClO+2SO
2SO
+Cl−的平衡常数K表达式为。
③如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果,从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是。

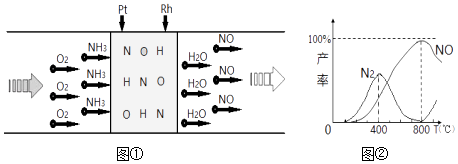
①写出总反应的化学方程式。
②MgOCO2也可以写成MgCO3 , 写出CO的VSEPR模型名称。
2H2(g)+O2(g)=2H2O(g) ΔH1
2CH3OH(g)+3O2(g)=4H2O(g)+2CO2(g) ΔH2
写出CO2催化加氢制甲醇的热化学方程式(ΔH用含ΔH1和ΔH2的代数式表示)。
②CO2催化加氢制甲醇过程中的主要竞争反应为:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41kJ/mol,在恒温密闭容器中,维持压强和投料不变,将CO2和H2按一定流速通过反应器,CO2转化率和CH3OH选择性[x(CH3OH)%=]随温度变化关系如图b所示,分析236℃以后,图b中曲线下降的原因。

③我国科学家设计了离子液体电还原CO2合成CH3OH工艺,写出碱性条件下CO2生成甲醇的电极反应式。
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49kJ·mol-1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41kJ·mol-1
III.CO(g)+2H2(g)⇌CH3OH(g) ΔH3
回答下列问题:

计算反应III的ΔH3=kJ·mol-1 , 其对应的曲线为(填“a”或“c”)

①图中代表CH3OH的曲线为(填“m”或“n”)。
②解释150~250℃范围内CO2转化率随温度升高而降低的原因。
③下列说法不正确的是(填字母)。
A.H2的平衡转化率始终低于CO2的
B.温度越低,越有利于工业生产CH3OH
C.加入选择性高的催化剂,可提高CH3OH的平衡转化率
D.150-400℃范围内,温度升高,H2O的平衡产量先减小后增大
④270℃时CO的分压为,反应II的平衡常数为(列出算式)。
甲醇的制备原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
①CO2(g)+H2(g) CO(g)+H2O(g)
kJ/mol
②CO(g)+2H2(g) CH3OH(g)
kJ/mol
根据盖斯定律,该反应的kJ·mol-1 , 反应能在(填“高温”或“低温”)自发进行。
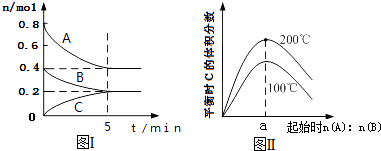
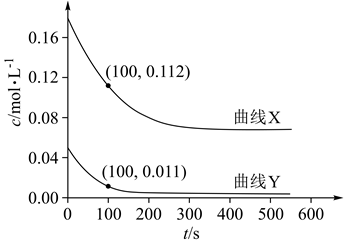
①反应开始到平衡,v(H2)=。
②该温度下的平衡常数K=(mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图像正确的是。


①生成CH3OH的最佳温度约为。
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因:。

2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g)∆H,在恒容密闭容器中,反应温度、投料比[
]对CO2平衡转化率的影响如图所示。a3(填“>”“<"或“=”);M、N两点的反应速率v逆(M)v正(N)(填“>”“<"或“=”);M、N两点的反应平衡常数KMKN(填“>”“<"或“=”),判断的理由是


I.C8H10(g)=C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1。
回答下列问题:
①0~20 min内,用C8H10的物质的量浓度变化表示的平均反应速率v(C8H10)=。
②反应II的平衡常数Kc=。
③起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。

由图可知,温度低于T0℃时,以反应(填“I”或“II”)为主,理由为;T1℃时,三条曲线几乎相交的原因为,P1、P2、P3由大到小的顺序为。
碳中和是指将人类经济社会活动所必需的碳排放,通过植树造林和其他人工技术或工程加以捕集利用或封存,从而使排放到大气中的二氧化碳净增量为零。
近期,中国科学院天津工业生物技术研究所在淀粉人工合成方面取得重大突破性进展,国际上首次实现了二氧化碳和水到淀粉(C6H10O5)n的从头合成。相关工作于2021年9月24日发表于国际学术期刊《科学》,实现 “从0到1”的突破。
a. 6CO2+6H2OC6H12O6 b.CO2+3H2
CH3OH十H2O
c.CO2+CH4C6H12COOH d.2CO2+6H2
CH2=CH2+ 4H2O
以上反应中,最节能的是,原子利用率最高的是。(填编号)
第一个步骤是把二氧化碳还原为甲醇(CH3OH),该方法的化学方程式是: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ∆H=-49.0 kJ;某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

|
序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
20.00 |
0.00 |
8 |
|
② |
20.00 |
20.00 |
6 |
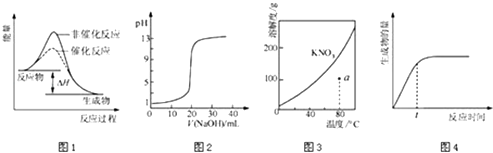
假设溶液混合前后的体积变化忽略不计,则x为
已知制备过程中还存在如下副反应:
Ⅰ.
Ⅱ.
①计算主反应的。
②该方法制备是低温氯化法,若反应温度较高造成的主要影响是,低温氯化法的主要不足之处是。

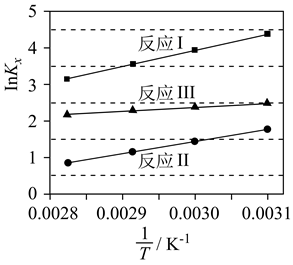
反应Ⅰ
反应Ⅱ
反应Ⅲ
①下列有关说法正确的是。
A.因为反应Ⅱ、Ⅲ自发,且为熵减小反应,所以、
B.若随温度的上升而增大,则
C.随温度升高,反应Ⅱ、Ⅲ的化学平衡先正向移动后逆向移动
D.当温度范围:T≤715K时,相同条件下的反应Ⅱ的平衡常数小于反应Ⅲ

②从图2中可看出,当体系温度高于600K时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:。
①平衡时的转化率为。
②已知810K条件下,存在等式(常数)
(对于气相反应,用某组分B的平衡压强p(B)可代替物质的量浓度c(B),如
, p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1~2.0MPa)关系的曲线示意图。
