

已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是( )


已知氯气溶解存在以下过程:
①Cl2(aq)+H2O(l)H+(aq)+Cl-(aq)+HClO(aq) K1=4.2×10-4
②Cl2(aq)+Cl-(aq)Cl
(aq) K2=0.19
③HClO(aq)H+(aq)+ClO-(aq) Ka=3.2×10-8
下列说法错误的是( )






已知:i.含镍溶液中的主要离子有:Ni2+、SO、Cu2+、Fe2+、AsO
、Ca2+和Zn2+
ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
物质 | 电离常数 | 物质 | 溶度积常数 | 物质 | 溶度积常数 |
H2S | Ka1=1.1×10−7 Ka2=1.3×10−13 | CuS | 6.3×10−36 | FeS | 6.3×10−18 |
NiS | 3.2×10−19 | Ni(OH)2 | 5.5×10−16 | ||
CaF2 | 4×10−11 | Fe(OH)3 | 2.8×10−39 |



相关信息如下:
①MgCO3 分解温度低于 CaCO3;
②金属离子形成氢氧化物沉淀的 pH 范围:
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Ca2+ | 11.3 | - |
| Mg2+ | 8.4 | 10.9 |
③AlCl3 易水解,易升华。请回答:
煅粉→加入适量 NH4NO3 溶液→( )→()→()→通入 NH3 和 CO2 , 控制pH<11.0→过滤→洗涤→CaCO3
a.过滤 b.控制 pH=11.0 c.控制 pH=8.0 d.取滤渣加水形成悬浊液 e.取滤液

提出假设:稀释溶液或改变
浓度,
电离平衡会发生移动。设计方案并完成以下实验用浓度均为
的
和
溶液,按下表配制总体积相同的系列溶液;测定
, 记录数据。
序号 | |||||
I | 40.00 | / | / | 0 | 2.86 |
II | 4.00 | / | 36.00 | 0 | 3.36 |
… | |||||
VII | 4.00 | a | b | 4.53 | |
VIII | 4.00 | 4.00 | 32.00 | 4.65 |
①根据表中信息,补充数据:a=,b=。
②由实验I和II可知,稀释溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据,给出判断理由:。
①移取溶液于锥形瓶中,加入2滴溶液R,用
溶液滴定至终点,消耗体积为
, 则R是(填名称),该
溶液的浓度为
。
I | 移取 |
II | (填实验操作步骤),测得溶液的 |
实验总结得到的结果与资料数据相符,方案可行。
|
① |
② |
③ |
④ |
|
|
|
|
|
A.稀盐酸 B.氢氧化钠溶液 C.淀粉碘化钾溶液 D.硝酸银溶液
室温下,用0.1mol/LNaOH溶液分别滴定20mL0.1mol/L的醋酸和盐酸溶液,滴定过程中溶液pH的变化曲线如下图所示。

①曲线Ⅱ表示滴定盐酸的过程,判断的理由是。
②a点溶液中,离子浓度大小关系为。
③b点溶液中,由水电离的。
④时,
(填“>”“<”或“=”,下题同)。
⑤c点溶液中b点的。
如测定血液中钙的含量时,进行如下实验:
ⅰ可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成
沉淀,过滤、洗涤,将沉淀用稀硫酸处理得
溶液。
ⅱ将ⅰ得到的溶液,再用
酸性溶液滴定,氧化产物为
, 还原产物为
。
ⅲ终点时用去的
溶液。
①写出用酸性溶液滴定
的离子方程式。
②如何判定滴定终点。
③计算:血液中含钙离子的浓度为(用字母表示)。
CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2= - 49.5 kJ/mol
则反应CO2(g)+ 2H2(g)=HCHO(g)+H2O(g) △H3=kJ/mol

①压强p1 P2(填“大于”或“小于”), 该反应达到平衡的标志是(填标号)。
A.反应速率v正(H2) =2v逆(CH3OH )
B.容器内CO和H2物质的量之比为1:2.
C.混合气体的质量不再变化
D.混合气体的平均摩尔质量不再变化
②a点条件下,H2的平衡转化率为 , 该温度下达到平衡后,在容积不变的条件下再充入mol CO和
mol CH3OH,平衡(填“ 正向” “逆向”或“不”)移动,新平衡时的逆反应速率 (填“大于” “等于”或“小于”)原平衡。

序号 | 现象 | 产生该现象的原因 |
1 | 酚酞颜色变浅直至褪去 | 用化学用语表达:①。 |
2 | 产生白色沉淀 | 用化学用语表达:②。 |
3 | 小灯泡变暗直至熄灭 | 文字表达:③。 |
4 | 小灯泡又变亮 | 用化学用语表达:④。 |

①II表示滴定的曲线(填“盐酸”或“醋酸”)。
②当滴定到pH=7时,消耗NaOH溶液的体积大的是(填“盐酸”或“醋酸”)。
③当V(NaOH)=10.00mL时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是。
④在上述滴定过程中,需要使用的玻璃仪器是(填序号)。
A.碱式滴定管 B.锥形瓶 C.容量瓶 D.玻璃棒
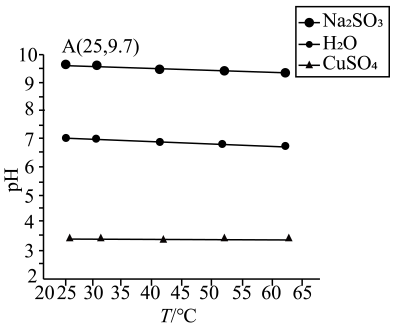
回答下列问题: