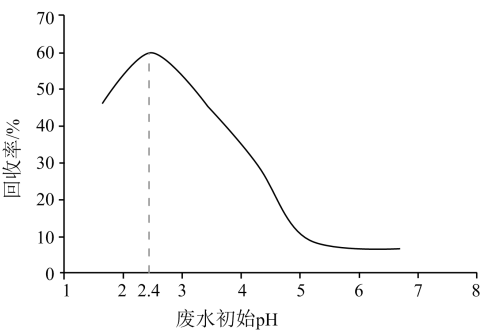

下列说法正确的是
| 试剂 | 现象 | |
| 1 | 酚酞 | 溶液变红,加水稀释,红色变浅 |
| 2 | 少量SO2 | 用pH试纸测得溶液pH≈8 |
| 3 | 少量Cl2 | 无明显现象 |
下列说法错误的是( )

 )溶液中含元素X物种的浓度之和为
)溶液中含元素X物种的浓度之和为 


实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① |
| 饱和 | 产生白色沉淀 |
② |
| 光照管壁有气泡产生 | ||
③ |
| 溶液变红 | ||
④ |
| 产生白色沉淀 |
以下判断错误的是( )
具体步骤如下:
Ⅰ.称取 , 用
水溶解。
Ⅱ.分批加入后,将溶液温度降至
以下,加入
活性炭、
浓氨水,搅拌下逐滴加入
的双氧水。
Ⅲ.加热至反应
。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
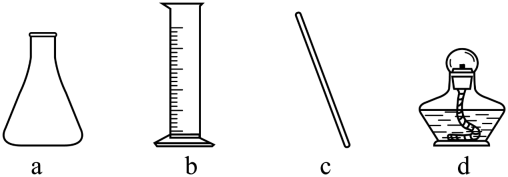
仪器a的名称是。加快NH4Cl溶解的操作有。

I.验证和
对Mg与水反应的促进作用
实验序号 | a | b | c | d |
0.1 mol·L | NaCl | |||
30 min内产生气体的体积/mL | 1.5 | 0.7 | <0.1 | 1.4 |
气体的主要成分 | ||||
30 min时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
该小组用Mg与NaCl溶液反应,实验发现当浓度过低或过高时,反应速率没有变化,当
浓度为2 mol·L
时,Mg与水反应较快,产生大量的气泡,同时生成白色固体,最终溶液pH约为10.98。
经检验该白色固体含有碱式氯化镁。碱式氯化镁受热(>100℃)易分解生成氧化镁和两种气体,写出其分解的化学方程式:。实验室检验镁条表面生成的白色固体含有碱式氯化镁的操作是。
I.铜盐的溶解:准确称取硫酸铜样品0.5g于碘量瓶中,加入1mol/L溶液和30mL
使之溶解。
II.滴定:向上述碘量瓶中加入5mL20%KI溶液,立即用0.1mol/L标准溶液滴定至浅黄色。然后加入1mL淀粉溶液,继续滴定溶液呈浅蓝色。再加入5mL10%KSCN溶液,摇匀后溶液蓝色转深,再继续滴定到终点,消耗
标准溶液的体积为
。回答下列问题:
A.  B.
B. 
C.  D.
D. 

锗元素原子核外能量最高的电子有个,它们运动所形成的电子云形状为形。
常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH(填“大于”“小于”或“等于”)后者。

Pb(NO3)2溶液中,2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有(填微粒符号)。
a.4~5 b.6~7 c.8~10 d.12~14
①通过检测出,证实反应A存在限度。
②加入 , 振荡,平衡向移动。
③除反应A外,还发生(写方程式),促进
与
的反应。
①甲同学认为加入溶液可增大
与
的反应程度。甲同学依据的原理是。
②验证:加入溶液,产生沉淀a,溶液蓝色褪去。能检出
。
查阅资料:
实验验证:

已知:、
(微溶)
①Ⅲ中溶液的作用是。
②Ⅳ中溶液的作用是(用离子方程式表示)。
检验、比较沉淀a、b的成分,可明确的作用。
i.与
在
的促进下发生的氧化还原反应
ii.与
在
促进下发生的反应
iii.与
的反应
确认是否发生反应iii,设计实验:将反应后混合物过滤,。
供选择试剂:稀、
溶液、
溶液
已知:、
溶于
溶液;
难溶于稀
 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
a.查阅资料:①常温下0.1mol•L-1的H2SO3溶液的pH约为2.1。②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol•L-1的H2S溶液的pH约为4.5。
b.实验操作:
①准确称取纯净的Na2SO3•7H2O晶体31.500g,配成1L水溶液,测得其pH=7.8。
②再次准确称取31.500g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重 (只有硫元素的化合价变化成最高价和最低价),质量为15.750g。
③将②所得的15.750g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250.00mL溶液,测得pH=10.3。
c.分析猜想:Na2SO3•7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
d.交流讨论

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图2所示。
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mLmol•L-1H2SO4和20mL10%KI溶液使铬元素完全转化为Cr3+ , 加水稀释至100mL。
步骤3:向碘量瓶中加入1mLl%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:)
①写出“步骤2”中反应的离子方程式。
②试计算的纯度(写出计算过程)

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |

向溶液中加入稍过量的锌粉,充分反应后,,得到ZnSO4溶液,,得到ZnSO4晶体。(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。

碳酸锂的溶解度(g/L)如表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
回答下列问题:

a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、洗涤、干燥得高纯Li2CO3。
①a中,阳极的电极反应式是,宜选用(填“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的离子方程式是。