
下列说法错误的是( )
实验现象 | 反应过程中的pH和电导率变化对比曲线 |
滴加氨水时,先不断产生浅蓝色沉淀;后来沉淀逐渐溶解,得到深蓝色溶液。 滴加硫酸时,先不断产生浅蓝色沉淀;后来沉淀逐渐溶解,得到蓝色溶液。 |
|
资料:ⅰ.实验中产生的浅蓝色沉淀为碱式硫酸铜,化学式为Cu2(OH)2SO4;
ⅱ.电导率是以数字表示的溶液中传导电流的能力。
下列分析中错误的是( )
选项 | 实验操作及现象 | 结论 |
A | 向某溶液中加入70%硫酸溶液后加热,并将气体产物依次通过品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊 | 该溶液中含亚硫酸盐 |
B | 向蛋白质溶液中加入饱和氯化铵溶液,有固体析出 | 蛋白质发生了变性 |
C | 将变黑的银器浸入盛有NaCl溶液的铝制容器中,银器由黑变白 | 生成了Ag |
D | 用pH计测CH3COONa溶液和NaF溶液的pH,前者大于后者 | Ka(HF)>Ka( CH3COOH) |

实验1:向4 mL 0.01 mol·L-1AgNO3溶液中加入2 mL 0.01 mol·L-1NaCl溶液,产生白色沉淀。
实验2:向实验1所得悬浊液中加入2 mL0.01 mol·L-1NaBr溶液,产生淡黄色沉淀,过滤。
实验3:向实验2所得淡黄色沉淀中滴入一定量Na2S溶液,产生黑色沉淀,过滤。
已知:室温下Ksp(AgCl)=2×10-10。下列说法正确的是( )

实验l:测得0.1mol·L-1H2S溶液pH=4.1
实验2:向10mL0.1mol·L-1NaHS溶液中加入5mL水,测得溶液的pH不断减小
实验3:向实验2所得溶液中滴加10mL0.1mol·L-1NaOH溶液,测得反应后溶液pH=12
实验4:向实验3所得溶液中滴加几滴0.1mol·L-1MnSO4溶液,产生粉色沉淀,再加几滴0.1mol·L-1CuSO4溶液,产生黑色沉淀
下列说法正确的是( )


已知:
I.As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O
II.As2S3(s)+3S2-(aq)2AsS
(aq)
III.砷酸(H3AsO4)在酸性条件下有强氧化性,能被氢碘酸等还原
下列说法错误的是( )

|
选项 |
实验操作和现象 |
结论 |
|
A |
向pH=3的HA和HB溶液中分别加水稀释至100倍,pH(HA)>pH(HB) |
酸性:HA<HB |
|
B |
向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 |
Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
|
C |
向FeBr2溶液中通入少量Cl2 , 溶液由浅绿色变为黄色 |
氧化性:Cl2>Br2 |
|
D |
向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 |
温度升高,Fe3+的水解程度增大 |
选项 | 实验操作和现象 | 结论 |
A | KBrO3溶液中加入少量苯,然后通入少量Cl2 , 有机相呈橙色 | 氧化性:Cl2>Br2 |
B | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀。 | Y中不含有醛基 |
D | 已知NaClO2溶液的pH>7,将其蒸干并灼烧得到固体残留物。 | 该固体为NaClO2 |

已知:月桂酸 熔点为
;月桂酸和
均难溶于水。该工艺条件下,稀土离子保持
价不变;
的
;
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
| 离子 | | | | |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
②“操作X”的过程为:先,再固液分离。
①还原 和
熔融盐制备
时,生成
![]() 转移
转移 电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
的还原,发生的电极反应为。
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物 | ||||
开始沉淀的 | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的 | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属
在醋酸中转化为
, 其化学方程式为;
(ⅲ)也能使
转化为
,
的作用是。
①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
|
实验操作 |
试剂 |
产物 |
|
|
I |
| 较浓H2SO4 | 有Cl2 |
| II | a | 有Cl2 | |
| III | a+b | 无Cl2 |
a是,b是。
编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | |||
体积 mL | 浓度 mol·L−1 | 体积 滴 | 浓度 mol·L−1 | 混合后Ag+浓度mol·L−1 | ||
① | 1 | 1 | 3 | 2 | 0.2 | 出现大量白色沉淀 |
② | 1 | 1 | 3 | 0.5 | 0.05 | 出现少量白色沉淀 |
③ | 1 | 1 | 3 | 0.1 | 0.01 | 有些许浑浊 |
④ | 1 | 1 | 3 | 0.01 | 0.001 | 无明显变化 |
实验一中产生沉淀的离子方程式为。
实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO)理论上至少达到mol·L−1。若向l mL某浓度的NaCl与Na2SO4混合溶液中加入3滴0.1mol·L−1AgNO3溶液,分析上面数据,判断下列说法正确的是(填字母序号)。
A.混合液中c(SO)=1mol·L−1时不会产生Ag2SO4沉淀
B.混合液中c(SO)=0.1 mol·L−1时不会产生Ag2SO4沉淀
C.无论SO浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol·L−1AgNO3溶液,可基本排除SO对Cl-检验构成的干扰
实验二:
编号 | AgNO3浓度/mol·L−1 | 现象 | 滴加硝酸后的现象 |
① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设二。
假设一:NO对Ag2SO4溶解起作用。
假设二:。
编号 | 操作 | 现象 | 结论 |
① | 取少量Ag2SO4于试管中,加入2mL水,振荡 | 固体不溶解 | |
② | 将①的浊液分成两等份 | ||
③ | 向其中一份加入1mL0.1mol/L的NaNO3 , 振荡 | 假设一不成立 | |
④ | 向另一份加入 | 假设二成立 |

相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |


金属离子沉淀完全时()及沉淀开始溶解时的pH如下。
金属离子 | ||||||
pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
沉淀开始溶解 | - | 13.5 | 14.0 | 10.5 | 12.0 | |
“氧化”过程中转化为
的离子方程式为。
①生成铬黄的离子方程式为。
②从平衡角度分析pH对沉铬率的影响。

“还原”过程中,被Cr(Ⅵ)氧化为。

沉淀剂1 | 沉淀剂1 | 沉淀剂1 | 过滤方式 |
| |
实验1 |
| NaOH溶液 |
| 逐一过滤 | 少量浑浊 |
实验2 |
|
| NaOH溶液 | 逐一过滤 | 少量浑浊 |
实验3 | NaOH溶液 |
|
| 逐一过滤 | 大量沉淀 |
实验4 |
| NaOH溶液 |
| 一起过滤 | 大量沉淀 |
①提出假设:
依据 | 假设 | |
假设1 | 实验1和2中 | (填化学式)能增大 |
假设2 | 实验3中 | NaOH能明显增大 |
假设3 | (将内容补充完整) | NaOH或 |
②设计实验:探究不同试剂对硫酸钡溶解度的影响程度
探究1 | 探究2 | 探究3 | 探究4 | |
实验流程 |
| |||
试剂 | 饱和食盐水 | 2 | 0.5 | 蒸馏水 |
现象 | 少量浑浊 | 大量沉淀 | 大量沉淀 | 无明显现象 |
“滤液处理”需用到的试剂有。
③实验分析:实验3中溶液的用量为理论值的1.5倍,最后仍检出
的原因是该体系中“同离子效应”“盐效应”(填“大于”或“小于”)。
④实验结论:粗盐提纯时,为了有效降低产品中含量,必须。

已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离出SO和一种阳离子,该离子能水解。
②Ksp[Al(OH)3]=6.4×10-34 , Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Fe(OH)2]=4.9×10-17。
③Ti3+在溶液中呈紫色,有较强还原性。
①转化:隔绝空气条件下,向溶液中加入铝片,Ti元素被还原为Ti3+ , 反应离子方程式为。
②滴定:溶液中Ti3+用含Fe3+的标准液进行滴定,用(填化学式)溶液作指示剂,滴定达到终点时的现象是。
资料1:金属离子沉淀的pH
Al(OH)3 | Cu(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | |
开始沉淀pH | 3.53 | 4.91 | 6.88 | 7.40 | 8.14 |
完全沉淀pH | 4.89 | 6.67 | 8.87 | 9.39 | 10.14 |
由数据分析,甲同学提出可以控制溶液pH至去除溶液中铜离子。
pH | 5 | 8 | 10 | 12 |
铜的沉淀率 | 2.3 | 7.2 | 9.8 | 12 |
由数据分析pH=12时铜的沉淀率为12%,远小于理论分析结果,分析可能原因。
结论:不可以通过调pH去除铜。
资料2:抗坏血酸(C6H8O6)具有较强的还原性,氧化后为脱氢抗坏血酸(C6H6O6);受热易分解。
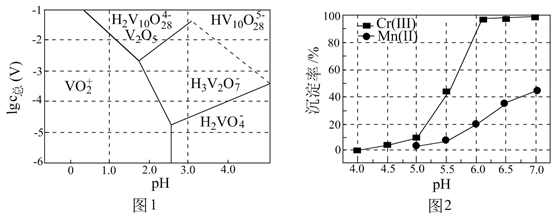
向柠檬酸浸出液中加入抗坏血酸能有效的将Cu2+还原成金属Cu。某实验小组研究了相同条件下,pH、反应时间和温度分别对Cu沉淀率的影响。
依据图1和图2,判断沉淀铜选择最佳pH为,理由是。


结论:可以通过还原法去除铜。
①用溶液、
溶液分步浸取磷灰石生成HF、
和
, 主要反应是
和。
②增大酸浸反应速率的措施有(只写1条)。
③其他条件不变时,若仅用溶液酸浸,浸取的速率低于用
、
分步浸取法,原因是。
将、
、
混合并调节溶液的pH制备
。
①酸性条件下,生成的离子方程式是。
②含磷各微粒的物质的量分数与pH的关系如图。

pH=1时,溶液中的 , 则
。再加入
晶体、
溶液使溶液中的
, 不考虑溶液体积的变化,通过计算说明此时能否产生
沉淀。
③的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
ⅰ.研究表明,沉淀时可加入含的溶液,
的作用是。
ⅱ.其他条件不变时,工业上选择pH=2而不是更高的pH制备 , 可能的原因是(答出2点)。
Ⅰ.70% 溶液与
粉末反应;Ⅱ.Cu粉与浓
在加热条件下反应。
①方案Ⅰ所涉及的化学方程式为。
②两种方案相比,方案Ⅰ的优点为。

①A中仪器m的名称为,装置B中盛放的试剂为。
②按气流方向,上述装置合理的连接顺序为a→→d(填仪器接口的小写字母)。
③装置C中仪器n的作用为。
查阅资料:为白色难溶于水的固体,能溶于
溶液;AgOH为白色难溶于水的固体,易分解,难溶于
溶液;
为白色固体,微溶于水,不易分解。
步骤一:将一定质量的配成250mL溶液,并测得溶液的
;将一定质量
配成250mL溶液,并分成两份,一份用
将pH调至8,另一份用NaOH溶液将pH调至11;
步骤二:将的
溶液滴入足量的
的
溶液中,开始产生白色沉淀,后沉淀变为棕黑色。
步骤三:将的
溶液滴入
的
溶液中,产生白色沉淀。
①步骤一中配置溶液所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要。
②步骤二中产生的棕黑色沉淀为 , 则该步骤产生的白色沉淀为(填化学式)。
③对步骤三中白色沉淀的组成提出假设:i.可能含有;ii.可能含有
;iii.可能含有AgOH。提出假设ⅱ的依据为;请设计实验方案验证假设ⅰ是否正确:。
②步骤ⅱ中的作用是。
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是。


已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀时pH | 6.3 | 1.5 | 3.4 | 6.2 | 7.15 |
完全沉淀时pH | 8.3 | 2.8 | 4.7 | 8.9 | 9.15 |
回答下列问题:
已知:i.Ni2++H2Y2-=[NiY]2-+2H+
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的操作和现象是。
②样品中镍元素的质量分数为%(精确到0.01)。