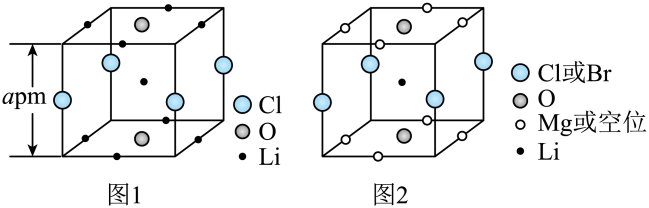




晶胞中的个数为。已知
的摩尔质量是
, 阿伏加德罗常数为
, 该晶体的密度为
。


酞菁分子中所有原子共平面,其中轨道能提供一对电子的
原子是(填图2酞菁中
原子的标号)。钴酞菁分子中,钴离子的化合价为,氮原子提供孤对电子与钴离子形成键。

 )是齿配位体,它的配位原子为,其中 C原子的杂化方式为。
)是齿配位体,它的配位原子为,其中 C原子的杂化方式为。
①铈具有三价和四价两种价态,三价和四价间的可逆转换会造成氧空位的生成和消除。其光催化的基本原理如下图所示,当光照能量( hv )等于或大于氧化铈催化剂的能量时,氧化铈VB上的电子(e-)会受到激发跃迁至CB,留下带正电荷的空穴(h+ ) ,形成光生电子−空穴对,与所吸附的物质发生氧化还原反应。则在氧化还原反应中,空穴可视为(填“氧化剂”或“还原剂”),图中A发生(填“氧化”或“还原”)反应。

②氧化铈的晶体结构如下图所示,其中铈原子和氧原子的数量之比为,若 晶体密度为d g∙cm−3 , 阿伏加德罗常数为NA , 晶胞参数a=cm( 写出表达式)。


A.氢键|B.极性键 C.π键 D.配位键

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②若晶胞中距离最近的两个铁原子距离为a pm,阿伏加德罗常数的值为NA , 则该晶体的密度为g/cm3(列出计算式即可)。
A. B.
B.
C.
D.
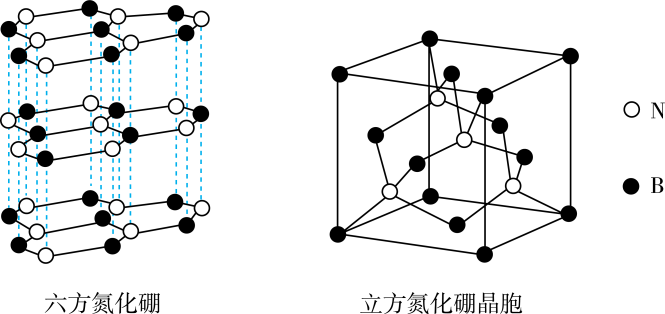
气体 | 溶解度/g | 分子结构特点 |
乙烷 | 0.0062 | 中心原子 |
乙炔 | 0.117 | 中心原子sp杂化,轨道半径较小,C负电性(δ-)及H正电性(δ+)明显 |
结合上表信息,说明乙烷与乙炔气体的溶解度存在差异的原因:。

①第一电离能比C、O都大的同周期主族元素是:(填元素符号)。
②乙酸晶胞的密度。

①。
②该结构不是晶胞结构单元,理由是;
③通过分析,金属离子的配位数为(填入序号)。
A.2、3 B.4、6 C.3、4 D.5、6
①中配合离子
中σ键和π键个数之比是,配体
杂化方式是。
②写出Zn的电子排布式,C、N、Na的第一电离能由大到小顺序为。
a.Po b.Na c.Zn d.Cu
②若Au的原子半径为a nm,Au单质的摩尔质量为M g/mol,阿伏加德罗常数为NA , 求Au单质的密度为。(用含a、NA、M的代数式表示)

物质 | 熔点 | 沸点 |
偏二甲肼 | -58℃ | 63.9℃ |
肼 | 1.4℃ | 113.5℃ |
偏二甲肼中氮原子的杂化方式为,二者熔沸点存在差异的主要原因是。


铁酸钇的化学式为。已知1号O原子分数坐标为(0,0,),2号O原子分数坐标为(
,
-m,
-n),则3号Fe原子的分数坐标为。已知铁酸钇的摩尔质量为Mg·mol-1 , 晶体密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 该晶胞的体积为pm3(列出表达式)。

①用实验测定铁晶体,测得A、B两种晶胞,其晶胞结构如图:

②A、B两种晶胞中含有的铁原子个数比为。
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有个。
①[FeCl4]-的中心离子是,配体是;其中的化学键称为。
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有,由此可知在高浓度Cl-的条件下[FeCl4]-才是稳定存在的。


①1个乙二胺分子中含sp3杂化的原子个数为,分子中电负性最大的元素是 ;
②Ni(H2O)6]2+中H2O与Ni2+之间以键结合在一起,在与乙二胺反应的过程中,Ni2+的轨道杂化类型是否发生改变? (填“是”或“否”) ;
③沸点:乙二胺(116℃)<乙二醇(197℃), 其原因是:。
①该晶胞中O原子的数目为。
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为g·cm-3(列出计算表达式)


① 分解得
。
空间结构为
②1体积水可溶解1体积 ,1体积水可溶解约700体积
。
极易溶于水的原因是。
③反应时,向饱和 溶液中先通入。
① 的中心原子的杂化轨道类型为。
② 存在配位键,提供空轨道的是。
③比较熔点:
(填“>”或“<”)。
|
氧化物 |
| | | |
| 离子键的百分数 | 62% | 50% | 41% | 33% |


化合物中电负性最大的元素是(填元素符号)。 分子中σ键和π键数目之比为, 分子内还含有下列作用力中的(填标号)。
A.氢键 B.离子键 C.配位键 D.金属键
①NiO晶胞结构类型与氯化钠相同,Ni和O的配位数依次为。
②某种铁的氧化物晶胞如图所示,它由A、B方块组成,该氧化物中Fe2+、Fe3+ 、O2-的个数比为。 已知晶胞中相距最远的Fe2+之间距离为xnm,晶体的密度为g·cm-3 (列出计算式,NA为阿伏加德罗常数的值)。

①1mol该配合物含有molσ键。
②已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则
中的大π键可表示为。


①S2O 中S-O-O(填“是”或“不是”)在一条直线上。
②S2O 中的O-O比H2O2中的更(填“难”或“易”)断裂。

①图中“●”代表的是(填“Mn”或“O”)。
②NA为阿伏加德罗常数,该晶体的密度为g·cm-3。
③MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如图。

从化学键的角度解释MnO2能结合NH3的原因:。该催化过程的总反应的化学方程式是。
①补全反应的离子方程式。
口Au+口 +O2+口
![]() =口[Au(S2O3)2]3-+口
=口[Au(S2O3)2]3-+口 ![]()
②简述 在金被氧化过程中的作用:。
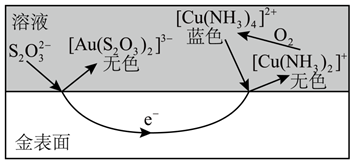
①上述原理可知,[Cu(NH3)4]2+在浸金过程中起作用。
②为了验证上述原理中O2的作用,进行如下实验。
实验现象:反应一段时间后,温度无明显变化,U形管内液柱左高右低,锥形瓶中溶液蓝色变浅,打开瓶塞后……
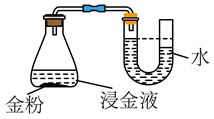
a.打开瓶塞后,(填实验现象),证实了上述原理。
b.a中现象对应反应的离子方程式是。
③下图表示相同时间内,配制浸金液的原料中c(CuSO4)对浸金过程中 消耗率和浸金量的影响(其他条件不变)。
已知:2Cu2++6 ⇌2[Cu(S2O3)2]3-+
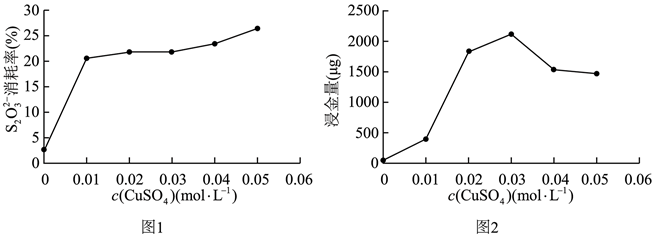
结合图1,解释图2中浸金量先上升后下降的原因:。

资料:
①吸附原理
螯合树脂M中的-COOH解离出H+ , 变成-COO- , 而且树脂中含有N原子,在与Cu2+接触时,树脂中的-COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
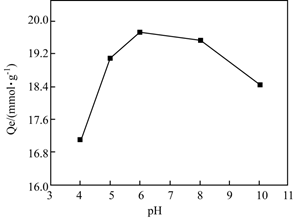
①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因。

研究表明,图a分子用于抗癌药物,在图a中用箭头标出配位键。解释分子b不溶于水的原因:。其中配体NH3中心原子的杂化方式为。

铜离子的电荷数为,其配位数为,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中a原子和b原子坐标分别为(0,0,0)、( ,
,
),则c原子分数坐标为,若晶体密度为dg/cm3 , 设NA为阿伏加德罗常数的值,则晶胞中阴阳离子最短距离为nm(列出计算式即可)。
 中电负性最大的元素是(填元素符号):①号碳原子的杂化方式是,②号碳原子的价层电子对数为.
中电负性最大的元素是(填元素符号):①号碳原子的杂化方式是,②号碳原子的价层电子对数为.

①有极性的结构是(填标号).
②中
中
的键角(填“<”、“>”或“=")
中
的键角.

已知1个晶胞中含4个Pd原子,其中3个Pd原子的坐标是 ,
,
则晶胞中每个Pd原子周围距离相等且最近的Pd原子有个;某铜钯合金
可看作上述Pd晶胞中位置的Pd原子被Cu原子替代.