事实 | 解释 | |
A | 气态 |
|
B |
|
|
C | 晶体熔点: |
|
D | 酸性: | 氟的电负性大于氯的电负性, |
 的沸点比
的沸点比
卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
a. b.
c.
d.
②一氯乙烷、一氯乙烯
、一氯乙炔
分子中,
键长的顺序是,理由:(ⅰ)C的杂化轨道中s成分越多,形成的
键越强;(ⅱ)。

已知阿伏加德罗常数为 , 则
晶体的摩尔体积
(列出算式)。
物质 | HCON(CH3)2 | HCONH2 |
相对分子质量 | 73 | 45 |
沸点/℃ | 153 | 220 |
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是。
物质 | CF4 | SiF4 | BF3 | AlF3 |
熔点/℃ | -183 | -90 | -127 | >1000 |
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是。

 中的大π键应表示为。
中的大π键应表示为。


|
氯化物 |
NaCl |
KCl |
RbCl |
CsCl |
| |
| 熔点/℃ | 801 | 776 | 715 | 645 | 405 | 714 |
A.二氧化硅晶体熔化 B.乙酸溶于水 C.干冰升华 D.冰融化

氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为,电子重排后的氧原子能量有所升高,原因是不符合(填“泡利原理”或“洪特规则”)。
|
化学键 |
B-H |
B-O |
B-B |
|
键能(kJ·mol-1) |
389 |
561 |
293 |
①F3B-NH3晶体中,B原子的杂化轨道类型为。
②F3B-NH3晶体中不存在的作用力有。
a.σ键 b.π键 c.离子键 d.配位键 e.范德华力
|
物质 |
AsF3 |
AsCl3 |
BiF3 |
|
沸点/℃ |
62.8 |
130.2 |
900.0 |
解释表中物质之间沸点差异的原因。
某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示。M是(填元素符号),判断理由是。
|
I1/kJ·mol-1 |
I2/kJ·mol-1 |
I3/kJ·mol-1 |
I4/kJ·mol-1 |
I5/kJ·mol-1 |
|
738 |
1451 |
7733 |
10540 |
13630 |

若阿伏加德罗常数的值为NA , 则该合金的密度ρ=g·cm-3(用含a、c、NA的代数式表示,列出计算式即可)。
①铁氰化钾中不存在的作用力有(填标号)。
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为(设NA为阿伏加德罗常数的值)。

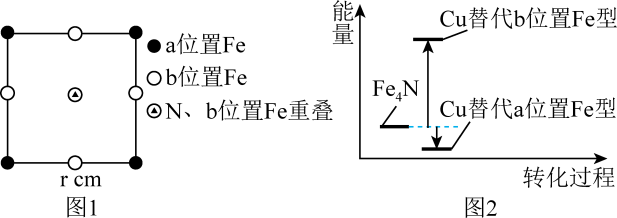
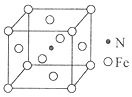
①该铁氮化合物的化学式为。
②计算Fe(Ⅱ)构成正八面体的体积为cm3。
①基态Co原子核外电子排布式为;
②基态磷原子中,电子占据的最高能层符号为;该能层能量最高的电子云在空间有个伸展方向。

这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为0.4665nm,NA为阿伏加德罗常数的值,则Li2O的密度为g·cm-3(列出计算式)。


①比较元素电负性:CN(填“>”或“<”),比较基态原子第一电离能:CPb(填“>”或“<”)
② 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于位置,X在晶胞中处于位置。
③ 晶体的晶胞边长为a nm,其晶体密度为d
,则阿伏加德罗常数的值NA的计算表达式为
a.离子键 b.氢键 c.σ键 d.π键
|
化合物 |
NaF |
MgF2 |
AlF3 |
SiF4 |
PF5 |
SF6 |
|
熔点/℃ |
993 |
1261 |
1291 |
-90 |
-83 |
-50.5 |
解释表中氟化物熔点变化的原因:。



①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(- ,-
,0);B处为(0,0,0);则C处微粒的坐标参数为。

②晶胞参数:描述晶胞的大小和形状。晶胞参数a pm,求CaF2晶体的密度为g·cm-3 , (NA为阿伏加德罗常数的值,用含a、NA的式子表示)。

该锰的氧化物的化学式为,该晶体中Mn的配位数为,该晶体中Mn之间的最近距离为pm(用a、b来表示)。


①1mol该离子中含有σ键的数目为。
②相同压强下,CO晶体的熔点高于晶体的原因是。
①1mol 含有mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为(用元素符号表示)。
③的空间立体构型为,其中硼原子的杂化轨道类型为。
A.1s22s22p13s1 B.1s22s22p2 C.1s22s22p13d1 D.1s22s23p1
化学键 | C=O | Si-O | C-C | Si-Si |
键能/kJ•mol-1 | 799 | 452 | 346 | 222 |
①金刚石和晶体硅的硬度:金刚石晶体硅(填“>、<、=”);原因是。
②二氧化碳和二氧化硅的熔点:二氧化碳二氧化硅(填“>、<、=”);原因是。
A.s-s共价键 B.s-p共价键 C.sp-s共价键 D.sp-p共价键


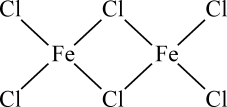 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。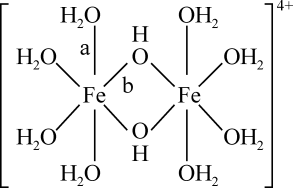
a.离子键|b.氢键 c.配位键 d.金属键