编号 | ① | ② | ③ | ④ |
溶液 | 氨水 |
| 醋酸 | 盐酸 |
11 | 11 | 3 | 3 |

实验1:测得溶液的
约为
。
实验2:向酸性溶液中滴加过量
溶液,溶液紫红色褪去。
实验3:向溶液中加入等体积等浓度
溶液,溶液变浑浊。
实验4:向溶液中滴加少量等浓度
溶液,无明显现象。
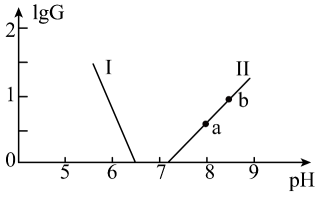
若忽略溶液混合时的体积变化,下列说法正确的是( )
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka1=1.77×10-4 | Ka1=4.9×10-10 | Ka1=4.3×10-7 ; Ka2=5.6×10-11 |
下列选项错误的是( )
弱酸 | HCOOH | HCN | |
电离平衡常数(25℃) |
|
化学式 | 电离常数 |
HClO | |
酸 | HA | HB | HC |
电离常数K |
有机酸 | HCOOH | CH3COOH | H2C2O4 |
电离常数 | Ka=1.8×10−4 | Ka=1.75×10−5 | Ka1=5.6×10−2 Ka2=1.5×10−4 |
回答下列问题(以常温为研究温度):
A. B.
B. C.
C. D.
D.
将实验一中的HAc溶液和与其等浓度的(简写为NaAc)溶液按一定体积比混合,测pH。
序号 | V(HAc)/mL | V(NaAc)/mL |
| pH | |
Ⅰ | 40.00 | 0 | 2.86 | ||
Ⅱ | 4.00 | 36.00 | 0 | 3.36 | |
… | |||||
Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |
根据表中信息,补充数据:a=,b=。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka =1.8×10-5 |
| 3.0×10-8 |
回答下列问题:
①25℃时,等浓度的三种溶液,酸性最强的是(填化学式),一般情况下,当温度升高时, (填“增大”、“减小”或“不变”);
②用蒸馏水稀释的醋酸,下列各式表示的数值随水量的增加而增大的是 (填序号)。
A. B.
C.
D.
③室温下,某溶液中存在着 CH3COOH(aq)+ (aq)
CH3COO-(aq)+H2CO3(aq),该反应的平衡常数K=。(用Ka、K1或K2表示)


将通入氨水中,当
降至
mol/L时,溶液中的
,将
通入
溶液发生反应的离子方程式为。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 |

②时,向
的
溶液中滴加等浓度等体积的
溶液(溶液体积变化忽略不计),则溶液中的
微粒浓度从大到小的排列顺序为.
酸 | ||||
下列说法正确的是____.
①与
反应的化学方程式为.
②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是.
酸 | 电离平衡常数 |
醋酸 | K=1.75× 10-5 |
碳酸 | K1=4.5×10-7 K2=4.7×10-11 |
亚硫酸 | K1=1.4×10-2 K2=6.0×10-8 |
其水解程度增大的是____(填字母)。
HSO3—⇋H+SO32- Ka2 , HSO3-+H2O ⇋H2SO3+OH- Kh2
已知25℃时,Ka2>Kh2 , 则0.1mol/L NaHSO3溶液:
①溶液呈(填“酸性”“碱性”或“中性”)。
②溶液中 c(Na+)c(HSO3-)。(填“>”“<”或“=”)
实验次数 | 1 | 2 | 3 | 4 | |
滴定前 | 滴定终点 | ||||
消耗 | 25.07 | 25.02 | 26.88 |
|
|
第4次滴定消耗溶液的体积为
, 则所配稀醋酸的物质的量浓度约为(保留4位有效数字)
.
浓度/ | 0.0010 | 0.0100 | 0.1000 |
3.88 | 3.38 | 2.88 |
醋酸 | 氢硫酸 | 氢氰酸 |
|
a.
b.
c. mol/L
a. b.
c.
d.
a. b.
c.
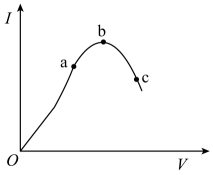
①电离平衡将(填“向电离方向”、“向生成醋酸分子方向”或“不”)移动;
②醋酸的平衡常数Ka将(填“增大”、“减小”或“不变”)
弱酸 | |||
电离平衡常数 (25℃) |
①依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为。
②向NaCN溶液中通入CO2气体,反应的化学方程式为。

化学式 | HClO | ||
电离平衡常数 |