 )降解的产物为丙酸
)降解的产物为丙酸













①晶胞中有个Ru,O在晶胞的位置为。
②已知与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。
载体中掺杂
的原因是。
 , 镓元素在元素周期表中的位置是。
, 镓元素在元素周期表中的位置是。
a.镓的金属性比铝的强 b.砷化镓具有半导体性质
c.As与H2在低温时可剧烈化合为AsH3 d.酸性:H2SO4>H3PO4>H3AsO4
亚砷酸(H3AsO3)可以用于治疗白血病。亚砷酸溶液中各种微粒物质的量分数与溶液pH关系如图所示。

铁是一种常见的金属,在生产生活中用途广泛。
构型为;1 mol Fe(CO)5分子中含有σ键为mol。
C、N、O元素的第一电离能的大小顺序为
已知该晶体的密度为dg·cm-3 ,阿伏加德罗常数的值为NA , 则该晶体的晶胞参数a=pm。(用含d和NA的代数式表示)。


①黄砷结构与白磷相似,黄砷的空间构型为,第三周期,第一电离能介于Al和P之间的元素有种。
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有(填标号)。

a.黑砷中As—As键的键能均相同
b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As—As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
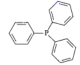 的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。
的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。
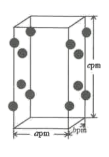
①晶胞中含有的Cl-数目为;
②若阿伏加德罗常数为NA , 则晶体的密度为g·cm-3.(列出计算式)
 )所含元素的电负性由大到小的顺序为。所含碳原子和硫原子的杂化类型分别为、。
)所含元素的电负性由大到小的顺序为。所含碳原子和硫原子的杂化类型分别为、。
 )和反-丁烯二酸(
)和反-丁烯二酸(  )的电离平衡常数如下表。
)的电离平衡常数如下表。 |
物质 |
电离平衡常数 |
|
|
顺-丁烯二酸 |
K1=1.17×10-2 |
K2=2.6×10-7 |
|
反-丁烯二酸 |
K1=9.3×10-4 |
K2=2.9×10-5 |
结合氢键,分析顺-丁烯二酸的K1明显大于反-丁烯二酸的原因是。

①该化合物中铜粒子的价电子排布式为,a、b氧粒子的坐标参数依次为(0,0,0)、( ,
,
),则d点粒子的坐标参数为。
②若a、b间的距离=xcm,计算该晶胞的密度g/cm3(写表达式)。