

已知:①反应I为快速反应,反应II、III为慢速反应;
②以5.0×10-3molBL或BD为初始原料,在493K、3.0×103kPa的高压H2氛围下,分别在恒压容器中进行反应(因反应I在高压H2氛围下进行,故H2压强近似等于总压),x(BL)和x(BD)随时间t变化关系如图所示[x(i)表示某物种i的物质的量与除H2外其他各物种总物质的量之比];达平衡时,以BL为原料,体系向环境放热akJ;以BD为原料,体系从环境吸热bkJ。

下列说法正确的是
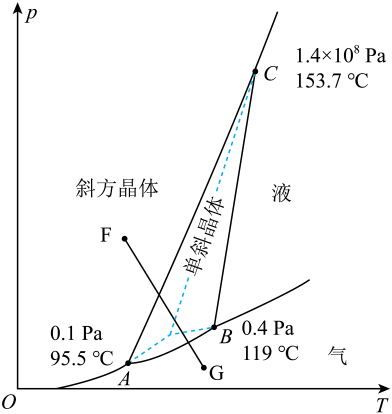
S(斜方,s)
;
S(单斜,s)
。
则下列有关说法中正确的是
物质 | S/(J·K−1·mol−1) | ∆H/(kJ·mol−1) | ρ/(kg·m−3) |
C(金刚石) | 2.4 | −395.40 | 3513 |
C(石墨) | 5.7 | −393.51 | 2260 |
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是
已知①
②
③
。
若某温度下,向VL密闭容器中加入2molNO和2molICl发生上述反应,达平衡时容器中NOCl(g)为amol,为bmol。下列说法错误的是( )

N2(g)+3H2(g) 2NH3(g) ΔH= −92.4 kJ∙mol−1
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
下列有关比轮正确的是( )










物质及共价键 | 键能/(kJ/mol) |
799 | |
436 | |
463 | |
x |
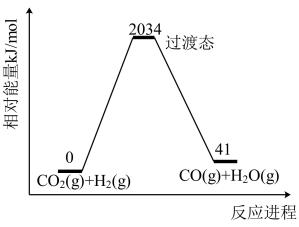
已知:
A.图中所示反应的逆反应活化能为2034


|
物质 |
C2H6(g) |
C2H4(g) |
H2(g) |
|
燃烧热ΔH/( kJ·mol−1) |
-1560 |
-1411 |
-286 |
①ΔH=kJ·mol−1。
②提高该反应平衡转化率的方法有、。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①设反应开始时的反应速率为r1 , 甲烷的转化率为α时的反应速率为r2 , 则r2= r1。
②对于处于初期阶段的该反应,下列说法正确的是。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小

①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为。



a.升温对反应I的化学反应速率影响更大
b.该条件下催化剂活性温度高于270℃
c.催化剂的选择应考虑提高生成的选择性
d.250℃时,不小于1.3
I.和
在一定条件下合成甲醇:



容积 | |||
甲容器 | VL | 1mol | amol |
乙容器 | VL | 2mol | 2amol |
①请在图中画出乙容器中的平衡转化率曲线乙。
②当乙容器中的平衡转化率与甲容器M点相同时,该反应的平衡常数之比
。
实验发现,其他条件不变时向上述体系中投入一定量的CaO,反应相同时间测得的体积分数增大,其可能的原因是。
①该反应在一定温度下能自发进行的原因为。
②已知键能是指气态分子中1mol化学键解离成气态原子所吸收的能量,上述反应中相关的化学键键能数据如下:
化学键 | C-H | C≡O | H-H |
键能/(kJ·mol-1) | 413 | 1075 | 436 |
则CO2(g)=C(g)+2O(g) ΔH=kJ·mol-1。
i.CH4(g)+CO2(g)2H2(g)+2CO(g)
ii.H2(g)+CO2(g)H2O(g)+CO(g) ΔH=+41.2kJ·mol-1
若在恒温、恒容密闭容器中进行反应i、ii,下列事实能说明上述反应达到平衡状态的是____ (填字母)。
①平衡时容器的体积是起始时的倍。
②该温度下反应i的压强平衡常数Kp=(Kp为用分压表示的平衡常数,分压=总压×物质的量分数)。
③维持其他因素不变,若向平衡体系中通入一定量的N2(N2不参与反应),再次平衡后CH4的转化率 (填“增大”“减小”“不变”或“无法判断”,下同),。

在Rh表面,每生成1molCO,则价带产生的空穴(h+)数为NA;价带上的电极反应式可表示为。
N2(g)+O2(g) 2NO(g) ΔH2= +160 kJ·mol-1
则ΔH=。

①下列叙述不能说明该反应已经达到平衡状态的是(填标号)。
A.CO2和N2的浓度比保持不变
B.压强不再变化
C.混合气体的密度不再变化
D.混合气体的摩尔质量不再变化
②压强p1 p2(填“>”或“<”, 下同), a、b两点的平衡常数KaKb。
③b点CO的转化率为%(保留一位小数),b点的Kp=(用含 p2的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 ×体积分数)。


①CO2(g)CO2(aq)
②CO2(aq)+H2O(1)H+(ag)+HCO
(aq) K
过程①的ΔH0(填“>”“<”或“=”)。溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol·L-1·kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为mol·L-1(忽略HCO和水的电离)。
反应I:C(s)+H2O(g)CO(g)+H2(g) ΔH1=+131.3kJ·mol-1 K1
反应II:C(s)+2H2O(g)CO2(g)+2H2(g) ΔH2=+90.3kJ·mol-1 K2
反应III:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.0kJ·mol-1 K3
上述反应的化学平衡常数随温度变化的关系如图所示,表示K1、K2、K3的曲线分别是c、、。

②研究表明,反应III的速率方程为v=k[x(CO)·x(H2O)-],x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数,随温度升高而增大。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示。根据速率方程分析T>Tm时,v逐渐下降的原因是。

主反应:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
温度为T℃,压强为p0的恒压密闭容器中,通入2molCH4和1molCO2发生上述反应。平衡时H2O(g)的分压为p1 , 甲烷的转化率为40%。
①下列说法正确的是(填标号)
A.ΔH1和ΔH2不变,说明反应达到平衡状态
B.相同条件下,主反应的速率大于副反应,说明主反应的活化能小
C.选用合适的催化剂可以提高主反应的选择性,增大甲烷的平衡转化率
D.平衡后,若增大压强,主反应平衡逆向移动,副反应平衡不移动
②平衡时混合气体的总物质的量为mol,H2(g)的分压是(用含p0和p1的计算式表示)。

a.TiO2(s) +2Cl2(g)TiCl4(g) +O2(g) ΔH1 =172 kJ·mol-1
b.TiO2(s) +2Cl2(g)+2C (s)TiCl4(g)+2CO (g) ΔH2
已知:C (s) +O2(g)CO2(g) ΔH3= -393.5 kJ·mol-1 , 2CO (g) +O2(g)
2CO2(g) ΔH4= - 566.0 kJ·mol-1
①直接氯化反应在(填“高温”“低温”)有利于自发进行。
②ΔH2=kJ·mol-1
③碳氯化法中生成CO比生成CO2更有利于TiO2转化为TiCl4 , 从熵变角度分析可能的原因是。
④已知常压下TCl4的沸点为136℃,从碳氯化反应的混合体系中分离出TiCl4的措施是。

①已知在200℃平衡时TiO2几乎完全转化为TiCl4 , 但实际生产中反应温度却远高于此温度,其原因是。
②图中a曲线代表的物质是 , 原因是。
③反应C (s)+CO2(g) 2CO (g)的平衡常数Kp(1200℃)= Pa。

则反应 △H=kJ/mol

①B容器中N2O的转化率随时间的变化关系是上图中的曲线(填“a”或“b”)。
②在密闭容器A中,下列事实能判断反应达到平衡状态的是。
A.气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.体系中CO的转化率不变 D.比值不再变化
③要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是。
④500℃该反应的化学平衡常数K=(用分数表示)。
化学键 | N≡N | H-H | N-H |
键能/(kJ·mol-1) | 946 | 436 | 390.8 |
①T℃时, 2NH3(g)⇌N2(g)+3H2(g)的ΔH =。
②T℃时,在1L密闭容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4 mol 、2 mol 、4 mol,则此时反应v正(N2)v逆(N2)(填“>”“<”“=”或“不能确定” )。

①为进一步提高NH3的平衡转化率,下列措施能达到目的的是(填字母)。
A.增大CO2的浓度 B.增大压强
C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)⇌NH2COONH4 (1) ΔH =-117 kJ/mol
b.NH2COONH4(1)⇌CO(NH2)2(1)+H2O(g) ΔH = +15 kJ/mol,
第一步反应速率快,可判断活化能较大的是 (填“第一步”或“第二步”)。
③某实验小组为了模拟工业合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应: 2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(g),反应过程中NH3的体积分数如图所示。实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数(MPa)-2(已知:分压=总压 ×体积分数)。

氰化氢可用甲烷氨氧化法合成,其热化学反应方程式为:
相关化学键的键能数据如下表:
化学键 | ||||
414 | 393 | 891 | 436.4 |
上述反应的为;
已知时有关弱电解质的电离平衡常数如下表:
弱电解质化学式 | |||||
电离平衡常数 |
①具有酸性,能与氨水发生反应:
, 此反应在常温下的平衡常数K约为;
溶液呈性。
②已知可发生如下反应: ,
,
, 则
的电离平衡常数的范围为:。
③在溶液中通入少量的二氧化碳,其离子反应方程式为:。
④浓度均为的
与
的混合溶液中,以下推断正确的是。
A.混合溶液约为9.3
B.
C.
①是一种无色、有毒、易溶于水的气体,易在空气中均匀弥散,并易产生爆炸。国家重点实验室对密闭空间内的
气体进行了消毒研究,研究中采用
气雾、
气雾和水雾分别单独对
进行消毒。由图可知 为最佳消毒试剂。

②工业生产中含氰废水主要来源于选矿、有色金属冶炼等工业,对于含氰废水都应高度重视并妥善处理,国家关于废水中总氰浓度排放标准为
。某工厂实验室针对不同浓度焦亚硫酸钠
处理含氰废水情况展开研究。反应如下:
如图为氧化后的浓度变化,如果你是工厂研究人员,你认为应选择多大浓度的
溶液最合理,请回答并说明理由。

Ⅰ.MgH2热分解放出H2
MgH2(s)Mg(s)+H2(g) ΔH=+75kJ/mol
该反应的能量变化如图。

MgH2与H2O反应制备H2的化学方程式是。

已知:ⅰ.
物质 | Mg(OH)2 | Ni(OH)2 | Cu(OH)2 |
Ksp | 5.6×10-12 | 5.5×10-16 | 2.2×10-20 |
ⅱ.MgH2在MCl2(M代表Mg、Ni、Cu)溶液中水解的示意图如图。

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是。
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是。
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是。