
下列说法正确的是( )


 ),阴极的主要电极反应式为
),阴极的主要电极反应式为




A | B | C | D |
|
|
|
|
制作简单的燃料电池 | 证明苯环使羟基活化 | 制备并收集NO2 | 检验溴乙烷的水解产物Br- |




下列说法错误的是

其中代表没参与反应的-COONa,
代表没参与反应的-ONa.下列有关说法错误的是
 D . 若电池充满电时a、b两极室质量相等,则放电过程中转移0.3mol电子时,两极质量差为6.9g
D . 若电池充满电时a、b两极室质量相等,则放电过程中转移0.3mol电子时,两极质量差为6.9g

选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | 酸性:苯酚>碳酸 |
B |
| |
C | 将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡 | 该装置构成了原电池,铝片做负极 |
D | 向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象 | 溶液中一定无 |
实验记录如下:
|
|
实验现象 |
|
|
实验Ⅰ |
|
极少量 |
|
实验Ⅱ |
|
部分 |
|
实验Ⅲ |
|
|
初始阶段,
被氧化的反应速率:实验Ⅰ
填“
”“
”或“
”
实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
蓝色
或
无色
, 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入
, 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤
的目的是。
查阅资料,
,
无色
容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
, 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓
溶液,
填实验现象
, 观察到少量红色的铜。分析铜未完全反应的原因是。


已知:I.阴、阳离子交换树脂的基本工作原理分别为、
(
表示树脂的有机成分)。
II.“沉钯”时得到氯钯酸铵固体,不溶于冷水,可溶于稀盐酸。

A.硫酸 B.盐酸 C.无水乙醇

稀硫酸的配制
①配制的
溶液,需
溶液的体积为mL。
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是(填仪器名称)。

【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
利用下表所示装置进行实验1~4,记录数据。
装置 | 实验序号 | 烧杯中所加试剂 | 电压表读数 | ||
| 30% | ||||
1 | 30.0 | / | 10.0 | ||
2 | 30.0 | 1.0 | 9.0 | ||
3 | 30.0 | 2.0 | 8.0 | ||
4 | 35.0 | 1.0 | |||
已知:本实验条件下,对电压的影响可忽略。
①根据表中信息,补充数据:。
②由实验2和4可知,(填“大于”或“小于”或“等于”),说明其他条件相同时,
溶液的浓度越大,其氧化性越强。
猜想1:酸性条件下,的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
装置 | 实验序号 | 操作 | 电压表读数 |
| 5 | / | |
6 | ①向(填“左”或“右”)侧烧杯中滴加 | ||
7 | 向另一侧烧杯中滴加 |
②实验结果为:、,说明猜想2不成立,猜想1成立。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
有氧条件下,NH3与NO反应生成N2 , 相关热化学方程式为
。

a.为催化剂,可以提高脱硝的速率和平衡转化率
b.状态②到状态③的变化过程决定了整个历程的反应速率
c.状态③到状态④中有非极性键和极性键生成
d.在图1所示历程中铜元素的化合价有发生变化
I.
II.
恒压下将CO2和H2按体积比混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内
的选择性和产率随温度的变化如图。

其中的选择性
①在上述条件下合成甲醇的工业条件是。
a.210℃ b.230℃ c.催化剂CZT d.催化剂
②在230℃以上,升高温度甲醇的产率降低,但CO2的转化率增大,原因是。

(a)CH3COOCH3(g)+2H2(g)C2H5OH(g)+CH3OH(g) △H=-23.6kJ·mol-1
(b)2CH3COOCH3(g)+2H2(g)CH3COOC2H5(g)+2CH3OH(g) △H=-22.6kJ·mol-1
(c)CH3COOCH3(g)+H2(g)CH3CHO(g)+CH3OH(g) △H=+44.2kJ·mol-1
上述三个反应中随着温度升高反应的平衡常数会逐渐增大(填a、b或c)。

①若n起始n起始(CH3COOCH3)=1mol,则500K下反应达到平衡时生成C2H5OH的物质的量为mol。
②673~723KCH3COOCH3平衡转化率几乎不变,其原因是。

①CO2在阴极上生成C2H5OH的电极反应式为。
②CO2转化为*CO的过程可描述为:溶液中的H2O在阴极表面得到电子生成*H。
+
→
+
→

已知:活性炭净化主要是除去有机杂质。
请回答以下问题:


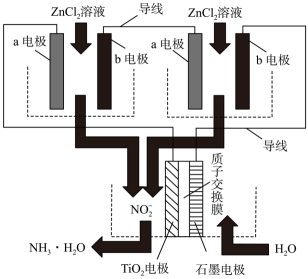
①写出电解时阴极的电极反应式。
②电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向阴极室加入(填化学式)。

溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
| 金属离子 | | | | |
| 开始沉淀 | 1.9 | 7.0 | 3.0 | 6.6 |
| 完全沉淀 | 3.2 | 9.0 | 4.7 | 9.1 |
回答下列问题:
A. 溶液 B.
C.稀硫酸 D.
滤渣X的成分是,调 的范围是。

闭合 时,电池复合膜中
向(填“左”或“右”)迁移;闭合
时,
电极发生的电极反应式为。

结合题给信息,请补充完整利用酸浸后的滤渣制备PbCl2晶体的实验方案:取一定量的滤渣,。(可选用的试剂有:蒸馏水,5mol·L-1NaCl溶液,1mol·L-1NaCl溶液,NaCl固体)
Ⅱ.2H2(g)+O2(g)2H2O(g) △H2=-484kJ•mol-1
则丙烷脱氢制丙烯反应C3H8(g)C3H6(g)+H2(g)的△H为kJ•mol-1
①0~10min丙烷的化学反应速率v(C3H8)=mol•L-1•min-1。
②下列情况能说明该反应达到平衡状态的是。
A.△H不变 B.C3H8与H2的物质的量之比保持不变
C.混合气体密度不变 D.混合气体的总压强不变

①此温度下该反应的平衡常数Kp=(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×体积分数)。
②已知该反应过程中,v正=k正p(C3H8),v逆=k逆p(C3H6)p(H2),其中k正、k逆为速率常数,只与温度有关,则图中m点处=。


从能量角度分析FeO的作用是。
CO2(g)+2CH3OH(g)CH3OCOOCH3(g)+H2O(g) ΔH
在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。

该反应的ΔH0(填“>”或“<”)。

电池的总反应式为。
①6O2+6e-=6O
②……
写出反应②的离子方程式:

资料:①滤液1、滤液2中部分离子浓度()
离子 | ||||
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 0.08 |
②EDTA能和某些二价金属离子形成稳定的水溶性络合物
③某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
1.33 | 1.17 | 1.01 | 0.85 | 0.72 | |
34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
上述流程中为加快化学反应速率采取的措施是。
将粗品溶于盐酸中作电解槽的阳极液,
稀溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极进行电解。电解后,向得到的
浓溶液中加入适量
溶液共热、过滤、洗涤、干燥得高纯
。
a.电解池中阳极的电极反应式是,宜选用(填“阴”或“阳”)离子交换膜。
b.生成高纯反应的离子方程式为。
需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是。