










和
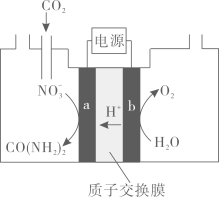
生成
;
分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是填序号
。
活化能:反应
反应
为放热反应,
为吸热反应
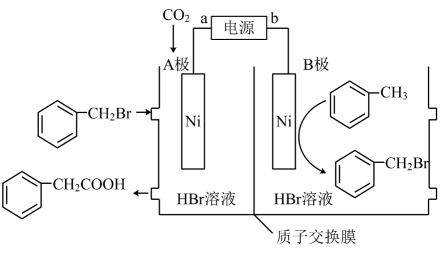
电极
是电解池的极。
电解过程中生成尿素的电极反应式是。
已知:溶液中不能直接用
溶液准确滴定。

消化液中的含氮粒子是。
步骤
中标准
溶液的浓度和消耗的体积分别为
和
, 计算样品含氮量还需要的实验数据有。

已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:

反应Ⅰ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2

实验序号 | 1 | 2 | 3 |
CH4浓度/mol·L-1 | 0.1000 | 0.2000 | 0.2000 |
H2O浓度/mol·L-1 | 0.1000 | 0.1000 | 0.2000 |
速率/mol·L-1·s-1 | 3.75×10-4 | 1.50×10-3 | 3.00×10-3 |
若某时刻,测得c(CH4)=0.4000mol·L-1 , c(H2O)=0.4000mol·L-1 , 则此时的反应速率v正=。

①600℃时,若经过tmin,反应达到平衡。该条件下,反应I的Kp=(MPa)2(列出计算式即可)。
②H2的含量在740℃左右出现峰值的原因为。

①CH4参与的电极反应为。
②经测定,原料气中各气体的体积分数为:
气体 | H2 | CH4 | CO | CO2 |
体积分数 | 82% | 3% | 5% | 10% |
若电解过程中消耗了100m3的原料气,则可得到相同条件下纯净H2m3。
I.2CO2 (g) +6H2(g)CH3OCH3(g) +3H2O(g) ΔH1= - 122. 5kJ/mol
Ⅱ.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=)

其中表示平衡时CH3OCH3的选择性的曲线是(填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是。
②对于反应Ⅱ的反应速率v=v正- v逆=k 正p(CO2)·p(H2) - k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压 ×物质的量分数)。
a.降低温度,k正- k逆(填 “增大”“减小”或”不变”);
b.在一定温度和压强下的反应Ⅱ,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时 v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=。
已知: 25℃,H2CO3 Ka1=4.5×10-7 Ka2=4.7 ×10-11; H2S Ka1=1.1 ×10-7 Ka2=1.3 ×10-13。请写出H2S与足量碳酸钠溶液反应的离子方程式:。

反应原理是:(i) Cl- 在阳极转化为Cl2;
(ii) Cl2在碱性溶液中歧化为ClO-;
(iii) ClO-将二甲胺氧化为N2 , 和H2O。
①写出电解池中阴极发生反应的方程式。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是。
③当阴极区收集到6.72L (标况下) H2时,阳极区收集到N2的体积(标况下)是L。
反应1 CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) ΔH=-165kJ⋅mol⁻¹
同时还发生的反应如下:
反应2 CO₂(g)+H₂(g) CO(g)+H₂O(g) ΔH=+41kJ⋅mol⁻¹
已知键能是指气态原子形成1mol化学键释放的能量,上述反应中相关的化学键键能数据如下:
化学键 | O-H | C-H | C=O | H-H |
键能/(kJ·mol⁻¹) | 463 | 414 | 802 | 436 |
则C(g)+O(g)=CO(g) ΔH=kJ⋅mol⁻¹。

①当反应1和反应2均达到化学平衡状态时,维持温度不变,增大容器体积,则反应2的平衡移动方向(填“正向移动”“逆向移动”或“不移动”),反应2的平衡常数(填“增大”“减小”或“不变”)。
②曲线Y表示的是(填含碳元素物质的化学式)的物质的量与温度的关系,曲线Z所表示的物质在800K~1100K之间物质的量增大的原因是。
③800K时,反应2的压强平衡常数Kp=(计算结果保留两位有效数字,用分压代替浓度,分压=物质的量分数×总压)。

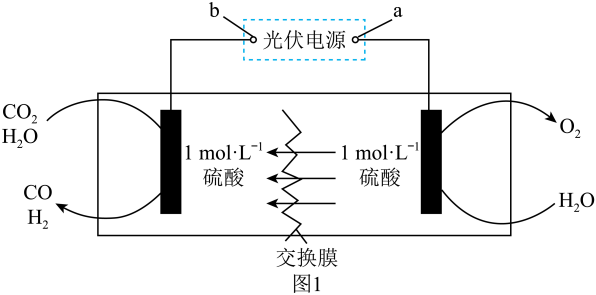
铂电极上生成HCOOH的电极反应式为;电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移1mole⁻时,阴极室溶液的质量增加g(CO₂溶解量不计)[B的电解效率=]。
II.水解制备偏钛酸:浸出液中含Fe3+、Ti4+等,先向其中加入还原铁粉,然后控制水解条件实现Ti4+水解制备偏钛酸。

备注:还原铁粉添加比=;n铁粉为还原铁粉添加量,n理论为浸出液中Fe3+全部还原为Fe2+所需的还原铁粉理论量。


电极X连接电源(填“正”或“负”)极。

①能说明容器中的反应均已达到平衡状态的是。
A.容器内气体的平均相对分子质量不变
B. CO2和H2的转化率相等
C. H2(g)与C(s)的物质的量之比保持不变
D.v(H2)=v( H2O)
②ΔH0( 填“>”“<”或“不确定”) ;理由是。
③改变的条件是。
反应I :CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH =-49.6 kJ ·mol-1
反应II :2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH =-23.4 kJ·mol-1
反应III :2CO2(g) +6H2(g) CH3OCH3 (g) +3H2O(g)
①反应III的活化能Ea(正)Ea(逆)(填“>”“<”或“=”)。
②在T1温度下,将6molCO2和14molH2充入2L的恒容密闭容器中发生反应I和III,达到平衡状态时CH3OH( g)和CH3OCH3( g)的物质的量分别为2 mol和1 mol。则T1温度时反应I的平衡常数K=。

①B中发生的总反应的离子方程式为。
②若某废气中含有的CO2和CO的体积比为1:1,废气中CO2和CO体积分数共为13. 44%。假设A中处理了标准状况下10 m3的废气,其中CO2和CO全部转化成CH3OH ,理论上可制得C2H4Cl2 kg。

A.v(CO2)正=v(H2)逆
B.HCOOH的体积分数不再变化
C.混合气体的密度不再变化
D.c(CO2):c(H2):c(HCOOH)=1:1:1
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.5kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.5kJ·mol-1
不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图所示:

压强p1、P2、P3由小到大的顺序是。压强为P1时,温度高于300℃后,CO2的平衡转化率随温度升高而升高的原因是。

请写出Cu电极上产生HCOOH的电极反应式。
第一步,利用太阳能收集空气中的和
;
第二步,在太阳能作用下将和
转化成合成气(CO、
);
第三步,利用合成气合成液态烃和甲醇。
Ⅰ模拟制备合成气的装置如图1所示。
回答下列问题:
已知:
,
表示
的摩尔生成焓,其余类推。
时,
、
、
的摩尔生成焓分别为
、0、
, 则上述反应的
。
实验 | 速率 | ||
Ⅰ | 0.10 | 0.10 | v |
Ⅱ | 0.20 | 0.10 | 2v |
Ⅲ | 0.20 | 0.20 | 8v |
Ⅳ | 0.40 | x | 36v |
计算x=。

该温度下反应的平衡常数为;若起始压强为 , 则
时容器中的压强为MPa;若保持其他条件不变,起始时加入
和
, 达到平衡,相应的点可能是图中A、B、C、D中的。


①该电池中b膜为离子交换膜。(填“阴”或“阳”)
②该电池正极的电极反应式为;当电路中转移1mol电子时,电极质量减少g。

①。
②向的溶液中加入等体积
的HCl后,体系中的Zn元素主要以(写微粒符号)形式存在。



①Y极与电源(填“正”或“负”)极相连。
②X极的电极反应式为。
③理论上,。

①实验中的作用是。
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当pH>12时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为。

③为使沉淀完全,调控溶液的pH最小值为。

①写出发生交换反应的平衡常数表达式,
。
②当pH>4时,Cr(Ⅵ)去除率下降的原因是。
①酸性废水中的Cr(Ⅵ)离子存在的主要形式为。
②当沉淀出2mol 时,阳极至少消耗mol Fe。

已知:I.常温下,钛与钯均不溶于盐酸。
II.PdCl在溶液中存在配位平衡:PdCl
(aq)
PdCl4(aq)+2Cl-(aq) △H>0
回答下列问题:
pH | 溶液中金属离子质量浓度(mg·L-1) | ||
Al3+ | Ni2+ | Ti4+ | |
1.1 | 6100 | 7780 | 46 |
2.1 | 5960 | 7430 | 3 |
3.4 | 212 | 6080 | 1 |
4.2 | 125 | 5870 | 1 |
5.2 | 107 | 3720 | 1 |

A.氨气极易溶于水,原因之一是分子和
分子之间形成氢键
B.分子和
分子空间构型不同,氨分子的键角小于水分子的键角
C.所含有的化学键有离子键、极性共价键和配位键
D.组成元素中电负性最大的是氮元素

①该合金的化学式为。
②已知该合金的密度为 , 阿伏加德罗常数值为NA , 则该晶胞的棱长为cm。