| 容器编号 | 温度( | 起始物质的量( | 平衡物质的量( | |
| | | | ||
| ① | 387 | 0.20 | 0.080 | 0.080 |
| ② | 387 | 0.40 | ||
| ③ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
| n/mol t/min | n(A) | n(B) | n(C) |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 |

时间/ min | 0 | t | 2t | 3t | 4t |
n(X)/mol | 2 | 0.4 | |||
n(Y)/mol | 4 | 0.8 | |||
n(Z)/mol | 0 | 1.4 |
下列说法正确的是( )



下列说法正确的是( )
| 容器 | 温度/K | 起始时物质的浓度/(mol·L−1) | 10分钟时物质的浓度/(mol·L−1) | |
| c(A) | c(B) | c(C) | ||
| 甲 | 448 | 3 | 1 | 0.5 |
| 乙 | T1 | 3 | 1 | 0.4 |
| 丙 | 448 | 3 | 2 | a |
下列说法错误的是( )
容器编号 | 压强 | 温度 | 起始物质的量/mol | 10s时物质的量/mol | |
A | B | C | |||
Ⅰ | 0.2 | 0.2 | 0.05 | ||
Ⅱ | 0.2 | 0.2 | 0.05 | ||
Ⅲ | 0.2 | 0.2 | 0.05 | ||
下列说法正确的是


①2SO2(g)+CH4(g) S8(g)+CO2(g)+2H2O(g)+Q1(Q1>0)
②2SO2(g)+CH4(g) S2(g)+CO2(g)+2H2O(g)+Q2(Q2>0)
在容积固定的2 L密闭容器中,通入2 mol SO2和1 mol CH4 , 一定条件下发生上述反应。完成下列填空:
A.CO2物质的量浓度不变 B.气体密度不变
C.容器内压强不变 D.容器内SO2与CH4的物质的量之比不变

a点是否已达到化学平衡状态?(选填“是”或“否”)。随着温度升高,SO2转化率先升后降的原因是。

0~2 h内,v(CH4)=。温度不变,若要提高SO2的平衡转化率可采取的措施是(任写一条)。


液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=kJ/mol。
反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为(保留2位有效数字)。
|
步骤 |
反应 |
正反应速率方程 |
逆反应速率方程 |
|
反应① |
CH4(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
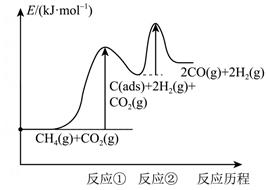
①反应速率快慢比较:反应①反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=(用k1、k2、k3、k4表示)。

随着进料比 的增加,
的值(填“增大”、“不变”或“减小”),其原因是。

空气反应器与燃料反应器中发生的反应分别如下:
反应1:
反应2:
反应3:
请回答下列问题:
①温度不变,将容器体积扩大至原来的2倍且不再改变,达到新的平衡时,气体压强
。
②当 的质量不变时,(填“能”或“不能”)说明该反应达到平衡状态。
③若达到平衡之后,保持恒温恒容条件下再充入少量 ,平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡之后,
的平衡转化率(填“增大”、“减小”或“不变”)。

反应I:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206 kJ∙mol−1
反应II:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=−41 kJ∙mol−1
①能判断反应:CO(g)+H2O(g) CO2(g)+H2(g)达到平衡的是。
A.CO的消耗速率等于CO2的消耗速率
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D.容器内气体压强不再变化
②达到平衡时,氢气的物质的量分数为20%,则CO的转化率为,计算该温度时反应的平衡常数K=。


回答下列问题:
a.气体颜色不变 b.气体压强不变
c.气体温度不变 d.混合气体的平均相对分子质量不变

已知:在T℃时,2HI(g)I2(g)+H2(g)的平衡常数K=
。
①曲线b代表的变化曲线(填化学式);
②2min内,用NH3表示的反应速率为,HI的分解率为。
③T℃时,若在丙容器中加入I2(g)和H2(g)各1mol;反应达平衡后,放出7.6kJ的热量,则I2(g)与H2(g)反应的热化学方程式为。
2021年9月23日,中国科学院召开新闻发布会,介绍我国科学家历时6年多科研攻关,世界上首次在实验室中实现从二氧化碳到淀粉分子的全合成。提纯含有氯化钠杂质的淀粉溶液的方法为。
存在反应:
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
II.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH2
①在一定条件下,仅发生反应II.在该条件下,向5L恒容密闭容器中充人物质的量之比为1:3的CO2和H2混合气体,在不同催化剂作用下合成二甲醚,相同时间内CO2的转化率随温度变化如图所示。

其中在催化剂(填“A”“B”或“C”)作用下,可使该反应的活化能最小。若忽略温度对催化剂的影响,则ΔH20(填“>”或“<”),理由是。
②一定温度下,向填充有催化剂的恒容密闭容器中充入等物质的量的CO2和H2 , 同时发生反应I和反应II,15min末反应达到平衡。测得反应前容器内压强为Po , 平衡时二甲醚气体的分压为P1 , 氢气的分压为P2.
(I)下列事实能说明容器内反应均达到平衡状态的是()。
A.氢氢键不再断裂 B.CO2与H2的个数之比不再改变
C.容器内气体的压强不再改变 D.容器内气体的密度不再改变
(II)二氧化碳的平衡转化率为(用含Po、P1、P2的代数式表示)。
(II)该温度下,反应II的平衡常数KP=(以分压表示,分压=总压×物质的量分数,用含P0、P1、P2的代数式表示)。
③二甲醚常用作燃料电池的燃料,若使用了1kg二甲醚,则理论上电路中通过的电量为库仑(保留两位有效数字,已知e=1.60x10-19C).



则H2(g)还原烟气中的SO2(g)的热化学方程式为。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)= mol/(L·s),平衡时,c(SO2)=mol/L;若平衡后升高温度,SO2的转化率将(填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=L/mol;平衡状态由A变到B,平衡常数K(A) (填“>”“<”或“=”)K(B)。

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是(填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
2NO(g)+O2(g) 2NO2(g) △H=-113.0 kJ·mol-1
①反应:NO2(g)+SO2(g) SO3(g)+NO(g)的△H=kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g) SO3(g)+NO(g),下列能说明反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变.
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
③测得②中反应达到平衡时NO与NO2的体积之比为37:13,则在该温度下反应:NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。下列说法正确的是 (填字母)。

已知:① ;
② ;
③ ;
则反应 的
。
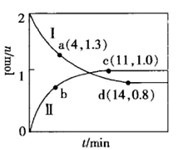
①代表220℃条件下的变化曲线为(填“I”或“II”);ad段 的平均反应速率为
。
②下列有关曲线II条件下的反应的说法正确的是(填标号)。
A.当体系中 与
的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
③图中a、c、d三点对应的逆反应速率由大到小的顺序为(用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp= (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。