

已知:在上述反应的温度下
① ,
;
②。

| 容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |

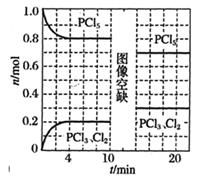
| 容器 | 起始容积 | 物质的起始加入量 | 平衡时Z的物质的量浓度 |
| 甲 | 2L | 1molX、1molY | 0.6mol·L-1 |
| 乙 | 5L | 2molW、4molZ | 0.48mol·L-1 |
下列说法错误的是( )
| 反应条件 | 反应时间 | | | | |
| 反应Ⅰ: 恒温恒容 | 0 | 2 | 6 | 0 | 0 |
| 10 | 4.5 | ||||
| 20 | 1 | ||||
| 30 | 1 | ||||
| 反应Ⅱ: 绝热恒容 | 0 | 0 | 0 | 2 | 2 |
下列说法正确的是( )
| 实验序号 | 实验温度 | 初始投料量 | | |
| | | |||
| 1 | | 10 | 10 | 50 |
| 2 | | 10 | 10 | a |
| 3 | | 15 | 10 | 40 |
下列说法正确的是( )
| 容器编号 | 起始浓度/mol·L−1 | |||
| H2 | CO2 | H2O | CO | |
| ① | 0.1 | 0.1 | 0 | 0 |
| ② | 0.2 | 0.1 | 0.2 | 0.1 |
①在催化剂存在下生成丙烯腈(C3H3N)的热化学方程式为C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
②得到副产物丙烯醛(C3H4O)的热化学方程式为C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
丙烯腈产率与反应温度的关系曲线如图所示。
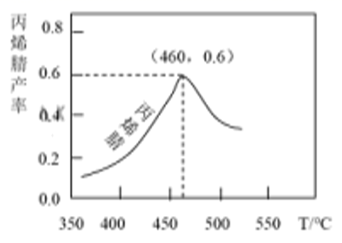
下列说法错误的是( )


t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是( )
实验编号 | 温度/℃ | 起始时物质的量/ | 平衡时物质的量/ | |
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
T(K) | 催化剂 | X转化率(%) | W选择性(%) |
543 | Ⅰ | 12.3 | 42.3 |
543 | Ⅱ | 10.9 | 72.7 |
553 | Ⅰ | 15.3 | 39.1 |
553 | Ⅱ | 12.0 | 71.6 |
该反应存在副反应,且100s时未达到平衡;W选择性是指转化的X中生成W的百分比。根据表中数据,下列说法错误的是( )
①
②
③
计算反应④的
;
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是,理由是;

苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进
(引发剂,X表示卤素)生成自由基
, 实现苯乙烯可控聚合。

NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
SO2(g)+O2(g)
SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。

a.升高温度 b.增大压强 c.加入催化剂

根据上述实验结果,可知,
。
则的
。
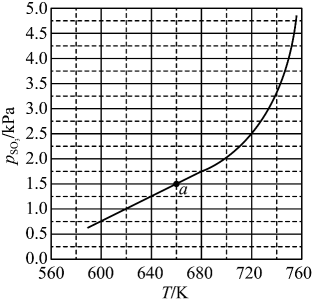


①图中压强由小到大的顺序为,判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、
时,氮气的转化率
。该温度时,反应
的平衡常数
(化为最简式)。

已知: ,

A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压

①甲烷的质量分数随温度变化的关系如图甲所示,曲线对应的
;
②反应体系中,随温度变化的关系如图乙所示,随着进料比
的增加,
的值(填“增大”、“不变”或“减小”),其原因是。

一定温度下,此反应的反应历程与体系能量变化关系如图1所示,则第二步反应的热化学方程式为。



①图中对应等温过程的曲线是(填“a”或“b”),判断的理由是。
②时,当
时,
的平衡转化率为
(保留小数点后一位)。

途径一,电还原经两步反应生成
:第一步为
(*表示微粒与
的接触位点):第二步为。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
|
化合物 |
Cr(OH)3 |
Ca(OH)2 |
Mg(OH)2 |
SrCO3 |
|
Ksp近似值 |
1×10-31 |
5.5×10-6 |
1.8×10-11 |
5.6×10-10 |
回答下列问题:

该反应历程中决速步反应的化学方程式为。


工业合成氨原理:N2(g)+3H2(g) 2NH3(g) △H。
c(N2)/(mol∙L-1) | c(H2)/(mol∙L-1) | c(NH3)/(mol∙L-1) | 速率 | |
I | 0.1 | 0.1 | 0.1 | v |
II | 0.2 | 0.1 | 0.1 | 2v |
III | 0.2 | 0.4 | 0.1 | 16v |
IV | 0.4 | 0.9 | 0.2 | 54v |
V | 0.4 | m | 0.4 | 64v |
则;
;
=;m=。

①P(填">”、“<"或“=")1.8MPa。
②投料比一定时,随着温度升高,不同压强下N2的物质的量趋向相等,其主要原因是。
③在1.8MPa、373K时,平衡常数Kp=MPa—2。(提示:用分压计算的平衡常数为Kp , 分压=总压×物质的量分数)

①写出N2O在Pt2O+的表面上反应的化学方程式。
②第一步反应的速率比第二步的( 填“ 慢”或“快”)。两步反应均为热反应。
①已知该反应为自发反应,则该反应的反应热△H 0. (选填“>”或“<”或“=”)
②一定温度下,将2 mol CO、4 mol NO充入一恒压密闭容器。已知起始压强为11 MPa,达到平衡时,测得N2的物质的量为0. 5 mol ,则该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=MPa -1(分压=总压×物质的量分数)。

①离子交换膜为离子交换膜。
②P极电极反应式为。
③工业上利用甲酸的能量关系转换图如图所示:

反应CO2(g) + H2(g) HCOOH(g)的焓变△H =kJ·mol-1。温度为T1℃时,将等物质的量的CO2和H2充入体积为1 L的密闭容器中发生反应:CO2(g)+H2(g)
HCOOH(g) K=2。 实验测得:v正=k正c(CO2)c(H2), v逆=k逆c(HCOOH), k正、k逆为速率常数。T1℃时,k逆= k正 ;温度为T2℃时,k正=1. 9k逆 , 则T2℃> T1℃,理由是。
化学键 | |||
键能E(kJ·mol-1) | 946.0 | 436.0 | 390.8 |
反应N2(g)+3H2(g)⇌2NH3(g) ∆H=kJ/mol

![]() 分别表示N2、H2、NH3
分别表示N2、H2、NH3
i.图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,图②到图③的过程能量(填“吸收”或“放出”)。
ii.N2的吸附分解反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料N2和H2物质的量之比为1︰2.8,分析说明N2过量的理由是和。
iii.关于合成氨工艺,下列说法正确的是。
A.控制温度(773K)远高于室温,是为了提高平衡转化率和加快化学反应速率。
B.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于化学平衡向正反应方向移动。
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率。
D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生。

i.M点和N点的平衡常数大小关系是KMKN(填“>”、“<”或者“=”)。
ii.M点的平衡常数Kp=MPa-2(计算结果保留到小数点后两位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
前体物之一,还可产生光化学烟雾和硝酸型酸雨,严重危害人类生命健康和破坏生态环境。回答下列问题:
氧化反应如下:
Ⅰ.NO(g)+O3(g) NO2(g)+O2(g) △H1=- 200.9 kJ·mol-1
Ⅱ.2NO2(g)+O3(g) N2O5(g)+O2(g) △OH2
①在298K,101kPa时,反应I的活化能为10.7kJ·mol-1 , 则其逆反应的活化能为kJ·mol-1
②在2L密闭容器中充入2molNO2和1molO3 , 在不同温度下,平衡时NO2的物质的量分数 (NO2)随温度变化的曲线如图甲所示。

ⅰ.反应Ⅱ的△H20(填“大于”“小于”或“等于”,下同),a点的V正b点的v正 , a点的v正 v逆。
ⅱ.图甲中,T2℃时,若考患2NO2(g) N2O4(g),平衡后,O2和N2O4的平衡分压相同,则反应Ⅱ以物质的量分数表示的平衡常数Kx=(保留两位小数,不考虑反应Ⅰ的影响)。
ⅲ.对反应体系无限加压,得平衡时a(O3)与压强的关系如图乙所示。压强增大至p1MPa之后,O3的平衡转化率a(O3)不再增大的原因是

①反应的化学方程式为。
②反应的催化剂为(填标号)。
①
②提高主反应选择性的最佳措施是。
A.降低温度 B.增大压强 C.增大c(H2) D.使用合适的催化剂

①下列有关说法错误的是
A.Pt原子表面上发生反应有N+NO=N2O、N+N=N2等
B.H2解离为H原子,溢流至HY载体上,将吸附于载体的NO2还原
C.从Pt原子表面解吸的NH3 , 在HY载体上转化为
D.HY载体酸性越强,其吸附NO2能力越强,Pt催化活性越大
②已知在HY载体表面发生反应的NO、O2物质的量之比为4:1,补充并配平下列化学方程式: +NO+O2=N2+H2O+。
| t/min | 0 | 10 | 20 | 30 | 40 |
| p/kPa | 24 | 22.6 | 21.6 | 21 | 21 |
①t=20min时,υ=mol·L-1·s-1(速率常数k=1.0×105mol-2·L2·s-1)
②用平衡分压代替平衡浓度可以得到平衡常数Kp , 则该条件下反应的平衡常数Kp=。