 下列分析错误的是( )
下列分析错误的是( )



已知:AG=lg , 电离度=
x 100%。
若忽略溶液混合时的体积变化,下列说法正确的是( )


下列说法不正确的是( )

| 选项 | 实验 | 现象 | 结论 |
| A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
| B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
| C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
| D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |

完成下列填空:
①NH4NO3晶体中所含化学键为。
② 若该污水中含有1mol NH4NO3 , 用以上方法处理完全后,共消耗mol氢气。
③ 该污水处理方法的好处是。
②常温下,0.0100mol/L NaOH溶液的pH=;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是(填“AgCl”或“Ag2S”)。
回答下列:
① 该反应的热化学方程式是 ;
② 该反应达到平衡后,升高温度平衡向 (填“正”、“逆”)反应方向移动;加入催化剂平衡(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是。
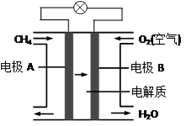 。
。

小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②;
③NO3- 在酸性环境下代替Fe3+氧化了SO32- , 同时消耗H+ , 使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2 , 使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
①克服锡单质这一弱点的方法之一就是做成合金,合金与组分金属相比一般具有性质。
a.不导电 b硬度大
c.耐腐蚀
②对锡器的“瘟疫”作分析,以下推测合理的是。
a.灰锡携带病毒
b.灰锡与白锡形成原电池,加速白锡的转化
c.灰锡是白锡转化的催化剂,加速反应
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
①过滤操作中使用的玻璃仪器有。
②如何证明晶体已洗净?。

①装置Ⅰ中盛放浓硫酸的仪器名称为;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是;裝置Ⅳ的作用是,盛装的试剂为。

①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因。
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为g·L-1 , 该数据说明某葡萄酒中SO2的残留量 (填“是”或“否”)达到我国国家标准。


①在上述滴定过程中,不需要使用的玻璃仪器是(填序号)。
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据判断滴定盐酸的变化曲线为(填“图1”或“图2”),判断的理由:
ⅰ、起始未滴加液时,
盐酸的
。
ⅱ、加入溶液恰好反应时,所得
溶液的
。
③滴定溶液的过程中,当滴加
溶液时,溶液中各离子浓度由大到小的顺序是(用符号“c”及“>”表示),此时溶液中
。
①的水解平衡常数
。
②该混合溶液的约为。
③该混合溶液中(填“>”“=”或“<”)
。

①已知催化剂“I”带一个正电荷,反应过程中的中间产物也带一个正电荷的是(填“II”“III”或“IV”)。
②由反应进程可知甲酸分解的(填“>”“=”或“<”)0,该历程中的决速步骤为(填选项字母),历程中最大能垒(活化能)
。
a.I转化为II的过程 b.II转化为III的过程
c.III转化为IV的过程 d.IV转化为I的过程