298K时,在20.0mL 0.10mol•L﹣1氨水中滴入0.10mol•L﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L﹣1氨水的电离度为1.32%,下列有关叙述正确的是( )

| 实验 | 装置 | 试剂a | 现象 |
| ① | | Ca(OH)2溶液(含酚酞) | 产生气泡 |
| ② | 少量NaHCO3溶液 | 紫色溶液褪色 | |
| ③ | 酸性KMnO4溶液 | 溶液褪色,产生白色沉淀 | |
| ④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
下列离子方程式或化学方程式错误的是( )


|
选项 |
实验操作和现象 |
结论 |
|
A |
向2mL0.1mol/L硝酸银溶液中加入1mL0.1mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1mol/L的Na2S溶液,有黑色沉淀生成 |
Ksp(Ag2S)<Ksp(AgCl) |
|
B |
两支试管,都加入2mL1mol/L的酸性KMnO4溶液,再同时向两支试管分别加入2mL0.1mol/L的H2C2O4溶液和2mL0.05mol/L的H2C2O4溶液,前者高锰酸钾溶液褪色时间短 |
增大反应物浓度化学反应速率加快 |
|
C |
经测定25℃时0.1mol/L的NaHC2O4溶液的pH≈5.5 |
|
|
D |
向盛有相同浓度KI3溶液的两支试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 |
溶液中可能存在平衡: |
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |


利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+![]() (对苯醌)═N2H4+
(对苯醌)═N2H4+![]() (对苯酚),N2H4的结构式为,该电池正极的电极反应式为.
(对苯酚),N2H4的结构式为,该电池正极的电极反应式为.
①当混合溶液中,c(NH4+)=c(Cl﹣)时.则溶液的pH=.
②当混合溶液中,c(NH4+)>c(Cl﹣)时.则反应的情况可能为.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
①写出该反应的化学平衡常数的表达式:,b(填“大于”、“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)(填“大于”、“小于”或“等于”)v逆(N2).
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol﹣1
写出氨高温催化氧化的热化学方程式.
298 K时,在2L恒容密闭容器中发生反应:2NO2(g) ![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。

①298k时,该反应的平衡常数为。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。

下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”“<”或“=”)。
NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①水的电离程度最大的是(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是;
③在c点,溶液中各离子浓度由大到小的排列顺序是。
稀土是我国战略性资源.氟碳铈矿主要化学成分为CeFCO3 , 它是提取铈族稀土元素的重要矿物原料.关于氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下:

请回答下列问题
①HT不溶于水,也不和水反应
②Ce3+不和萃取剂HT发生反应
③Ce3+在萃取剂HT中溶解度大于水
④萃取剂HT的密度一定大于水
盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的操作(填“甲”、“乙”、“丙”)。选择酚酞作为指示剂,滴定终点的现象为。
|
滴定次数 |
待测盐酸的体积/mL |
消耗0.100mol/LNaOH溶液的体积/mL |
|
|
滴定前读数 |
滴定后读数 |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
|
第三次 |
25.00 |
0.22 |
26.31 |
则盐酸的物质的量浓度为mol/L。(保留三位小数)
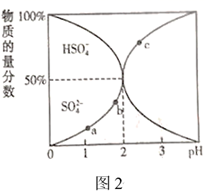
图中a、b、c三点,水电离的 由大到小的顺序分为(用a、b、c表示),pH=3时,
。
|
化学式 |
| | | |
| | | | | |

① ②
③
④
水的电离程度由小到大的顺序为;

①在酸性条件下, 将
氧化的离子方程式为。
② 标准溶液应选用下图中的(填“甲”或“乙”)盛装;
③将锥形瓶置于滴定管下方进行滴定时,眼睛注视直至滴定终点;判断到达滴定终点的现象是。
④软锰矿中 的质量分数为。
请写出操作步骤的正确顺序___________(填序号)。
|
醋酸 |
碳酸 |
亚硫酸 |
|
Ka=1.75×10-5 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
①由上表数据可知,Na2SO3溶液显性,其原因是(用离子方程式表示)。
② 时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为 (用字母表示)。
③工业上可用氨水除去尾气SO2 , 将SO2通入氨水中,当c(OH-)降至1.0×10-8mol/L时,溶液中的 = (保留三位有效数字)。

①B点溶液中,离子浓度由大到小的顺序为:。
②HA的电离常数Ka= (请用含x的代数式表示)。
①0.1mol/L的CH3COOK溶液和0.1mol/LHCOONa溶液相比,(填“<”、“=”或“>”)。
②向0.1mol/LHCOOH溶液中滴加相同浓度的NaOH溶液,当溶液中时,此时溶液的pH=。