

A.sp B.sp2 C.sp3 D.sp3d
硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
| | | | | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
①0℃时, 、
、
、
呈液态的是(填化学式),沸点依次升高的原因是,气态
分子的空间构型是;
② 与N-甲基咪唑
![]() 反应可以得到
反应可以得到 ,其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为,H、C、N的电负性由大到小的顺序为,1个 中含有个
键;

①已知化合物中 和
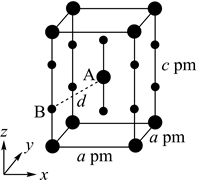
的原子个数比为1:4,图中Z表示原子(填元素符号),该化合物的化学式为;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度
(设阿伏加德罗常数的值为
,用含a、b、c、
的代数式表示)。
KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
|
N—N |
N≡N |
P—P |
P≡P |
|
193 |
946 |
197 |
489 |
从能量角度看,氮以N2、而白磷以P4(结构式可表示为  )形式存在的原因是。
)形式存在的原因是。
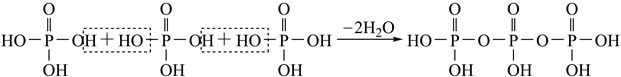 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。

①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__(填标号)。
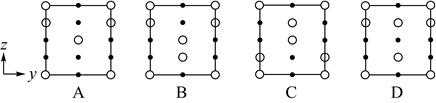
a. b.
c. d.

 )可与氨反应转化为吡咯(
)可与氨反应转化为吡咯( )。二者均存在与苯类似的大
)。二者均存在与苯类似的大 的大
的大
①据此推断该晶胞中氯原子数目为。的摩尔质量为
, 晶胞密度为
, 则阿伏加德罗常数的值
为(列出计算表达式,后同)。
②图中A、B两原子的核间距为nm。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
|
冠醚 |
冠醚空腔直径/pm |
适合的粒子直径/pm |
|
12冠醚- 4 |
120~ 150 |
Li+ (152) |
|
15 -冠醚-5 |
170~ 220 |
Na+ (204) |
|
18 -冠醚- 6 |
260~ 320 |
K+ (276) |
|
|
340~ 430 |
Rb+ (304) |
|
Cs+ (334) |
18-冠醚-6不能识别和运输Na+和Cs+的原因是。观察图甲,冠醚不能识别和运输X-的主要原因可能是。


铷晶胞的原子空间利用率为(用含π的式子表示)。


①原子位于S原子形成的(填“正四面体”或“正八面体”)中心。
②以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,1号S原子坐标为
, 3号S原子坐标为
, 则2号S原子坐标为。
③已知:晶体的密度为
,
为阿伏加德罗常数的值。则
晶胞中阴、阳离子最近距离为
。
A.![]() B.
B. C.
C.![]() D.
D.![]()

①Cr与Mo同族,Cr基态原子的外围电子排布式是,核外未成对电子数有个。
②该超分子中除配位键外还存在的化学键类型有(填标号)。
A.氢键 B.σ键 C.π键 D.离子键
③与金刚石均为碳的单质,从结构与性质之间的关系解释
的熔点远低于金刚石的原因是。




①镀铜反应中,利用了的性。
②选择进行化学镀铜的原因之一是它易溶于水。下列分析正确的是
a.、
均属于极性分子
b.与
之间能形成氢键
c.在醛基的碳氧双键中,电子偏向碳原子
 (EDTA4-)
(EDTA4-)
中除部分O外,还能与
配位的原子是。

上述方法不适合在该聚酰亚胺基材上直接镀铜。原因是:
①。
②聚合物有可能与配位。
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
 )分别以任意比互溶。
)分别以任意比互溶。 ①二甲基亚砜分子中硫原子的杂化类型为 。
②丙酮分子中各原子电负性由大到小的顺序为。
③沸点:二甲基亚砜 丙酮(填“>”或“<”),原因为 。
④二甲基亚砜能够与水以任意比互溶的原因为 。
 , 该配合物中心原子Cr的价层电子数为 。[已知:配合物二茂铁(
, 该配合物中心原子Cr的价层电子数为 。[已知:配合物二茂铁(①该晶体中锰原子的配位数为 ;
②已知锰和硫的原子半径分别r1 nm和r2 nm,该晶体中原子的空间利用率为(列出计算式即可)。


 形成。
形成。①形成该镍配合物的元素中,第二周期元素的第一电离能最大的为(用元素符号表示) ,配合物中N采用的杂化类型为。
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为(填“C”、“N"”或“O"),原因为。

①该新型超导材料的化学式为。
②若晶胞参数为a nm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。
①的电子式为。
②的熔点高于
其原因是。
①基态Pb的价层电子排布式为。
②已知甲基的供电子能力强于氢原子,则比
接受质子能力较弱的原因是。

①代表的为。
②原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为 , B为
, 则C的原子分数坐标为。
③已知的摩尔质量为
, 则该晶体的密度为
(设
为阿伏加德罗常数的值)。
④该晶胞沿体对角线方向的投影图为(填标号)。
a.  b.
b. c.
c. d.
d.
①该配合物的一种配体是NH3。NH3的空间结构呈形,是(填“极性”或“非极性”)分子。
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个和3个。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,(补全实验操作和数据)。
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。

①图2中Ⅱ型小立方体分别是b、(填字母序号)。
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=。

①已知大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则环戊二烯负离子(C5H5)的大π键可表示为 ;
②二茂钴是紫黑色晶体,熔点约173℃,不溶于水和液氨,但能溶于有机溶剂,下列相互作用中,二茂钴晶体中不存在的是;
A.离子键 B.配位键 C.范德华力 D.氢键

则一个氯离子周围距离最近的配离子的数目为,若此配合物晶体的密度为g·cm-3 , 则[Co(NH3)5Cl]2+与氯离子之间的最短距离是nm(设配合物相对分子质量为M)。


 )、乙醇混合溶液,将析出一种晶体X(晶胞结构如图),甲酸根全部被交换到溶液中。X对热稳定,磁矩约为1.7B。M(磁矩=
)、乙醇混合溶液,将析出一种晶体X(晶胞结构如图),甲酸根全部被交换到溶液中。X对热稳定,磁矩约为1.7B。M(磁矩=
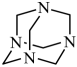 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
a.sp2与sp2 b.sp3与sp c.sp3与sp3 d.sp3与s e.s与s


① Cl2O2的沸点比H2O2低,原因是。
② O3分子中心原子杂化类型为;O3是极性分子,理由是。
方法Ⅰ Na2O + NaClNa3OCl
方法II 2Na + 2NaOH + 2NaCl2Na3OCl + H2↑
① Na2O的电子式为。
② 在方法Ⅱ的反应中,形成的化学键有(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键

①Na3OCl晶胞中,Cl位于各顶点位置,Na位于位置,两个Na之间的最短距离为nm。
②用a、d表示阿伏加德罗常数的值NA=(列计算式)。
①其中A型的晶胞如图所示,晶胞边长为a nm,CaTiO3的相对式量为M,阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为g.cm-3。

②如果将晶胞原点移到Ca2+上,就是CaTiO3的B型结构。请在虚线框内图示画出B型晶胞的结构图。(注意请用黑色签字笔作图)
