






①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。



①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是。
②的立体构型为,中心原子的杂化类型是。

晶体中
;已知原子A、B的分数坐标分别为
和
, 则原子C的坐标为,设阿伏加德罗常数的值为
,
的密度为g·cm
。
①已知Co(NH3)5BrSO4中Co(III)的配位数为6,向该配合物的溶液中滴加BaCl2溶液,无明显现象,则该配合物可表示为。
②[Co(NH3)6]3+结构如图所示,Co3+位于正八面体中心,若其中两个NH3被Cl-取代,则[Co(NH3)4Cl2]-的空间结构有种。

②负极材料LiC6晶胞结构如图(c),Li原子插入石墨层中间,若该晶胞中碳碳键键长为mpm。石墨层间距为npm。该晶体的密度为g•cm-3(用NA表示阿伏加德罗常数的值)。


物质 | |||
熔点( | 约 |
①的分子空间构型为。
②熔点的原因是。

该有机配合物中锗的配位数为,其阴离子中C、、O元素的第一电离能从大到小顺序为。

①该锗化合物晶胞的表示方式有多种,图中(填“b”“c”或“d”)图也能表示此化合物的晶胞。
②用表示阿伏加德罗常数的数值,计算晶胞(a)密度为
(用含x、y、z和
的式子表示)。



A.sp2 B.sp3 C.sp3d D.sp3d2

①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为。
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为,Bi与Li(1)和Li(2)之间的最短距离的比值为。

①基态Cu原子的M层电子排布式为。
②CO和N2互为等电子体。标准状况下V L CO分子中π键数目为。



①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为。


①配合物中每个中心离子的配位数为。
②Co2+的最高能层电子排布式为。
③下列状态的钴中,电离最外层一个电子所需能量最大的是(填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
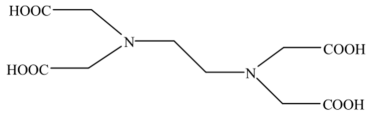
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因。
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因。

氨的沸点(填“高于”或“低于”)膦(PH3),原因是
氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为。

①晶胞中铜原子与镍原子的数量比为。

已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为,该物质的化学式为,已 知钙和氧的最近距离为a pm。晶体的密度ρ g·cm-3 , 则阿伏加德罗常数NA= mol-1( 用含a和ρ的式子表示,列出计算式即可)。
①配合物的熔点为-20℃,沸点为103℃,可用于制备纯铁。
的结构如图所示。下列关于
说法错误的是(填序号)。

A.是分子晶体
B.中Fe原子的配体与
互为等电子体
C.中σ键与π键之比为1∶1
D.反应中没有新化学键生成
②的电子式为。
③(尿素)中N原子的杂化方式为,组成尿素的4种元素的第一电离能由大到小的顺序为。

①Ni的配位数为。
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为。
 B .
B .  D .
D . ①H2O分子的键角小于H3O+离子的键角,原因是。
②画出可能的一种结构式。

①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为g/cm3。
②图乙的结构可用化学式TiO2-xNy表示,其中x=。
 ;使B原子最外层达到稳定结构(如图一)。则B2H6中B原子的杂化方式为。
;使B原子最外层达到稳定结构(如图一)。则B2H6中B原子的杂化方式为。


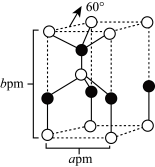
①横线上物质的空间构型为 。
②六方氮化硼晶体结构与石墨相似(如图三),N- B键键长为apm,晶体的层间距为bpm,则六方氮化硼晶体的密度为 g·cm-3(列出计算式,用NA表示阿伏加德罗常数的值)。


 )具有良好的抗炎活性。下列说法正确的是。
)具有良好的抗炎活性。下列说法正确的是。a.Se采用sp3的方式杂化
b.分子中各个C原子的杂化方式不同
c.分子中既含有极性共价键,又含有非极性共价键
d.分子中和
的键角相同



