

步骤1:用Na2S2O3溶液浸泡照相底片,未曝光的AgBr转化成Na3[Ag(S2O3)2]而溶解。
步骤2:在步骤1所得溶液中加稍过量Na2S溶液,充分反应后过滤出黑色沉淀。
步骤3:将黑色沉淀在空气中灼烧,回收单质银。
下列说法正确的是( )

步骤1:向盛有硫酸铜水溶液的试管中加入氨水,首先生成难溶物,继续添加氨水并振荡试管,难溶物溶解,得到深蓝色的透明溶液。
步骤2:再向试管中加入乙醇,析出深蓝色的晶体。
下列说法错误的是( )



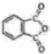 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(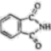 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
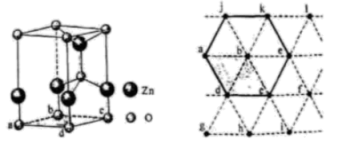

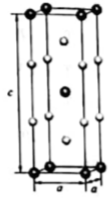
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为
,则c点锰原子坐标为。
过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
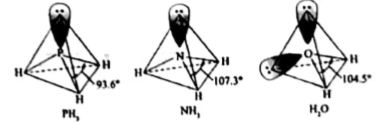
PH3中P的杂化类型是, NH3的沸点比PH3的,原因是。H2O的键角小于NH3的,分析原因。

|
坐标 原子 |
x |
y |
z |
|
Cd |
0 |
0 |
0 |
|
Sn |
0 |
0 |
0.5 |
|
As |
0.25 |
0.25 |
0.125 |

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是。
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。

②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式。
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式。
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有mol。


①该溴化物的化学式为 。
②原子坐标参数表示晶体内部各原子的相对位置。上图中各原子坐标参数P为(0,0,0),Q为 (),
则R原子的坐标参数为。
③已知该溴化物密度为ρg·cm-3 , Cu原子半径为xpm,Br原子半径为ypm,阿伏加德罗常数为NA , 则该晶胞中原子空间利用率为。(列出计算式)
①基态钛原子的核外电子排布式为。原子中运动电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的则用
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为。
②已知部分物质的熔沸点如下表。
TiN | ||||
熔点/℃ | 800(分解) | -25 | 714 | 2950 |
沸点/℃ | 700(升华) | 136.4 | 1412 | (略) |
属于晶体,中心Ti原子的杂化方式为。
①根据相似相溶的规律,可推断(填“甲”或“乙”)在水中的溶解度较大。
②发生水解反应的化学方程式是。
③和
中铂的配体数分别为和。
④查阅资料可知,甲、乙均为平面结构。画出乙的水解产物的空间结构并推测其不能与草酸反应生成的原因:。



①每个晶胞含Cs3MnCl5的单元数有个。
②Cs沿z轴投影图正确的是(填标号)。
A.  B.
B.  C.
C.  D.
D. 
①第一电离能:NO(填“>”或“<”)
②苯酚中碳原子杂化类型为。


A.离子键 B.配位键 C.极性共价键 D.非极性共价键 E. 键 F.
键

其中铁酸钇的化学式为,已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
,
-m,
-n),则3号Fe原子的空间坐标为,若晶胞参数分别为a pm、b pm和c pm,阿伏加德罗常数的值用
表示,则该晶体的密度为
(列出表达式)




 B .
B .  C .
C .  D .
D . 
①与KSCN中与SCN-互为等电子体的非极性分子的化学式为
②SCN-中碳原子杂化类型为。
A. 键 B.配位键 C.非极性键 D.σ键

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( ,
,
)。则D原子的坐标参数为,它代表原子。
②若晶胞参数为a nm,阿伏加德罗常数的值为NA , Cu2O晶体密度ρ为 。
①与铜离子形成配合物的分子或离子应具备的结构特征是。
②配位体 中N原子的杂化类型为,
配离子
中含有
键的数目为。
③写出与CO互为等电子体的一种分子的化学式。
① 与
形成配合物的能力大于
的原因为。
②溶液中的水存在 、
等微粒形式,
可看作是
与
通过氢键形成的离子,写出
的结构式。

①Ni(NH3)6]SO4中阴离子的立体构型是。
②在[NiNH3)6]SO4中Ni2+ 与NH3之间形成的化学键称为,提供孤电子对的成键原子是。