 B .
B .  D .
D . 选项 | 实验目的 | 实验操作 |
A | 测定新制氯水的pH | 将干燥的pH试纸放在玻璃片上,用干燥洁净的玻璃棒蘸取新制氯水,点在pH试纸上 |
B | 制取干燥纯净的CO2气体 | 将含少量HCl杂质的CO2气体依次通过饱和NaHCO3溶液和浓硫酸 |
C | 配制0.4000 mol·L-1的NaOH溶液 | 用滤纸称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容 |
D | 鉴定CH3CH2Br中的溴元素 | 将CH3CH2Br与NaOH水溶液共热后,滴加AgNO3溶液 |
A | B | C | D |
|
|
|
|
制取乙烯 | 提高HClO浓度 | 配制250mL0.10mol·L-1NaOH溶液 | 除去乙烯中的少量SO2 |


 B .
B .  D .
D . 

| | | | |
| A.洗涤烧杯并将洗涤液转入容量瓶中 | B.制备并观察 | C.实验室快速制备 | D.实验室制备乙酸乙酯 |
| 编号 | 实验过程 | 实验目的 |
| A | 称取11.7g固体NaCl置于500mL容量瓶中,加入适量蒸馏水溶解,定容 | 配制0.4 mol/L的NaCl溶液 |
| B | 常温下,测定等物质的量浓度的盐酸和醋酸溶液的pH | 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH |
| C | 向Na2SO3溶液中加入Ba(NO3)2溶液和稀HNO3 , 观察实验现象 | 检验Na2SO3溶液是否变质 |
| D | 无水乙醇与浓H2SO4共热至170℃,将产生的气体通入溴水,观察溴水是否褪色 | 证明乙烯跟溴水发生反应 |
 B .
B .  D .
D . 
| | | | |
| A | B | C | D |
 B .
B .  C .
C .  D .
D . 
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |

提出假设 稀释 溶液或改变
浓度,
电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的
和
溶液,按下表配制总体积相同的系列溶液;测定
,记录数据。
|
序号 |
|
|
|
|
|
|
Ⅰ |
40.00 |
/ |
/ |
0 |
2.86 |
|
Ⅱ |
4.00 |
/ |
36.00 |
0 |
3.36 |
|
… |
|||||
|
Ⅶ |
4.00 |
a |
b |
3∶4 |
4.53 |
|
Ⅷ |
4.00 |
4.00 |
32.00 |
1∶1 |
4.65 |
①根据表中信息,补充数据: ,
。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡(填”正”或”逆”)向移动;结合表中数据,给出判断理由:。
③由实验Ⅱ~VIII可知,增大 浓度,
电离平衡逆向移动。
实验结论 假设成立。
查阅资料获悉:一定条件下,按 配制的溶液中,
的值等于
的
。
对比数据发现,实验VIII中 与资料数据
存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定
溶液的浓度再验证。
(ⅰ)移取 溶液,加入2滴酚酞溶液,用
溶液滴定至终点,消耗体积为
,则该
溶液的浓度为
。在答题卡虚线框中,画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ)用上述 溶液和
溶液,配制等物质的量的
与
![]() 混合溶液,测定pH,结果与资料数据相符。
混合溶液,测定pH,结果与资料数据相符。
|
Ⅰ |
移取 |
|
Ⅱ |
,测得溶液的pH为4.76 |
实验总结 得到的结果与资料数据相符,方案可行。

|
阳离子 |
u∞×108/(m2·s−1·V−1) |
阴离子 |
u∞×108/(m2·s−1·V−1) |
|
Li+ |
4.07 |
|
4.61 |
|
Na+ |
5.19 |
|
7.40 |
|
Ca2+ |
6.59 |
Cl− |
7.91 |
|
K+ |
7.62 |
|
8.27 |
配制500mL的KI溶液,需要称取KI的质量为g。
 B .
B .  C .
C .  D .
D . 组别 | 温度 | KI溶液 |
| 蒸馏水 | 淀粉溶液 | ||
c(KI) | V | V | |||||
1 | 298K | 5mL | 5mL | 10mL | 3滴 | ||
2 | 313K |
| 5mL | 10mL | 3滴 | ||
3 | 298K | 10mL | 5mL | 5mL | 3滴 | ||
酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为。
试剂:KI溶液,
溶液,淀粉溶液,
溶液,KSCN溶液。实验如下:

甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为;乙同学认为该现象无法证明该反应为可逆反应,原因为。
量取6.8mL30%H2O2溶液放于反应容器中,再加入2.4g尿素。控制60℃下加热几分钟,得到无色溶液。继续加热,观察到针状晶体在溶液中逐渐生长,至只有极少量水时,停止加热,冷却至室温。晶体置于滤纸上几分钟,称重记录3.6g。
制备时,加入过氧化氢略过量,其目的是。
A.圆底蒸发皿![]() B.坩埚
B.坩埚 C.烧杯
C.烧杯![]() D.瓷制研钵
D.瓷制研钵
实验步骤:填写下述测定步骤中的空白。
取ag产品至50mL烧杯中,,将溶液转移至100mL容量瓶中定容并摇匀。吸取10.0mL溶液于中,加入100mL水和20mL10%硫酸,用cmol/LKMnO4溶液(不与尿素反应)滴定至粉红色,30s不褪色。共重复平行测定三次,平均消耗bmLKMnO4溶液。
数据分析:


①实验中,使淀粉碘化钾试纸变蓝的物质是,而后碘被(填“氧化”或“还原”)导致蓝色褪去。
②对比实验Ⅰ和Ⅱ的现象可以说明乙醇被NaClO氧化,理由是。
③实验过程,测得实验Ⅰ中混合溶液的pH由12.38逐渐增大至12.80,说明乙醇与NaClO反应可能生成。
①滴定前,将锥形瓶置于“冷暗处”的目的是,写出NaClO与KI反应的离子方程式。
②滴定终点溶液的颜色是,84消毒液与医用酒精1:1反应后溶液中NaClO的质量分数=(结果保留3位有效数字;I2+2S2O =2I-+S4O
)。
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量酸雨于A、B两支洁净试管中,待用 |
无明显现象 |
|
步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 |
有白色沉淀 |
|
步骤3:取少量步骤2得到的滤渣加入过量盐酸 |
滤渣不能完全溶解,说明酸雨中含有硫酸 |
|
步骤4:取适量步骤2得到的滤液, |
|
|
步骤5:往B试管中加入,振荡 |
|
①标准溶液配制:实验室用1.000mol·L-1较浓的碘水配制250mL0.02000mol·L-1的碘水溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需要的仪器有、。
②滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴溶液作指示剂,将0.02000mol·L-1碘水装入50mL酸式滴定管,滴定终点现象为,记录数据,重复滴定2次,平均消耗碘水VmL。

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液。
①冷凝管1、冷凝管2中进水接口依次为、(填字母);冷凝效果更好的是(填“冷凝管1”或“冷凝管2”)。
②加热温度不宜超过60℃的原因是。
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:
![]()
)
①用浓缩的68% 溶液代替常见的30%
浴液的目的是;浓硫酸的作用是。
②充分搅拌的目的是。
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入 溶液、3滴
溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI ( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂2.0mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
标准溶液滴定至蓝色刚好褪去(
)。重复步骤b、步骤c三次,测得平均消耗
标准溶液的体积为20.00mLmL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶、玻璃棒和量筒外,还需要。
②设计步骤b的目的是。
③过氧乙酸的质量分数为%。

已知:①酸浸后的溶液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
| 沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
|
银盐性质 |
AgCl |
AgI |
AgCN |
Ag2CrO4 |
AgSCN |
|
颜色 |
白 |
黄 |
白 |
砖红 |
白 |
|
Ksp |
1.8×10-10 |
8.3×10-17 |
1.2×10-16 |
3.5×10-11 |
1.0×10-12 |
①滴定时可选为滴定指示剂的是(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:。

已知:①锂电池废料的主要成分是 LiCoO2、铝、炭黑及其他杂质。
②“溶液 A”中主要金属离子是 Co2+、Li+ , 还含有少量 Fe3+、Al3+、Cu2+。
请回答:
步骤Ⅲ中 LiCoO2 固体溶解的化学方程式为 ;

①配制约 0.30mol•L﹣1 盐酸溶液不需要用到的仪器有 (填编号)
a. 量筒 b.电子天平 c. 漏斗 d. 烧杯 e. 容量瓶 f. 玻璃棒 g. 胶头滴管
②用 0.3000mol•L﹣1 盐酸标准溶液滴定,其中正确操作步骤的顺序为
a. 加入 0.1-0.2mL 甲基红—溴甲粉绿作指示剂;
b. 煮沸去除 CO2 , 再冷却到室温;
c. 将试样置于 250mL 锥形瓶中,加入 20mL 水溶解;
d. 用盐酸标准液滴定至试液由绿色变成酒红色;
e. 继续滴定至酒红色(滴定突跃区域)即为终点
③碳酸锂的纯度可用下式计算:ω= ×100%
其中:ω—碳酸锂试样的纯度; m—碳酸锂试样的质量(g);
c—盐酸标准液的浓度(mol•L﹣1)
V1—试样滴定时消耗盐酸的体积(mL);
V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL)0.03694—与 1.00mL 标准盐酸(c=1.000 mol•L﹣1)相当的碳酸锂的质量(g) 滴定空白溶液的目的是
上述滴定操作中,缺少“煮沸去除 CO2 , 再冷却到室温”这个步骤,测定结果将
(填“偏大”、“偏小”、“无影响”)
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为,同时洗涤(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式;
②提出假设二的可能依据是;
③验证假设三是否成立的实验操作是。

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是 (写化学式)。
|
实验原理 |
m=cVM |
|
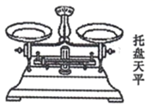
实验仪器 |
药匙、烧杯、托盘天平、玻璃棒、、胶头滴管 |
|
实验步骤 |
⑴计算:需要称取NaOH固体g。 ⑵称量:用托盘天平称取所需NaOH固体。 ⑶溶解:将称好的NaOH固体用适量蒸馏水溶解。 ⑷转移、:将烧杯中的溶液冷却至室温后,注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中。 ⑸定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用滴加蒸馏水至液面与刻度线相切。 ⑹摇匀:盖好瓶塞,反复上下颠倒,然后静置。 |
|
思考与讨论 |
如果省去实验操作③,配出来的溶液浓度(填“>”、“=”或“<”)1.0mol/L。 |
