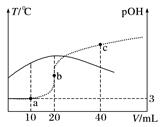
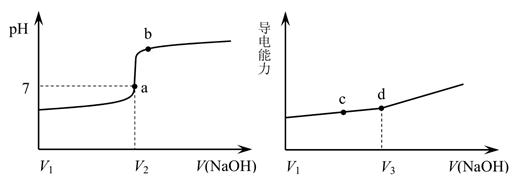
下列图示与对应的叙述不相符合的是( ) 





已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)

 反应达到平衡后,升高温度,平衡常数K值变大
B .
反应达到平衡后,升高温度,平衡常数K值变大
B .  表示镁条放入盐酸中生成氢气速率随时间的变化
C .
表示镁条放入盐酸中生成氢气速率随时间的变化
C .  表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D .
表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D .  表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化


下列说法错误的是( )




Ⅰ.取样、氧的固定
用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+ , 在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32﹣+I2=2I﹣+S4O62﹣).
回答下列问题:

①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
A中装有无碱玻璃棉,其作用是。采样步骤②加热烟道气的目的是。
C中填充的干燥剂最好的选择是(选填编号)。
a.碱石灰 b.无水CuSO4 c.P2O5

将一定量的气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3- , 然后加入过量的FeSO4标准溶液,充分反应后,再用K2Cr2O7标准溶液滴定剩余的Fe2+。
NO被H2O2氧化为NO3-的离子方程式是。滴定操作使用的玻璃仪器主要有。
 。
。

“转化”中反应的化学方程式为:“低温放置”的目的是、

实验准备
①H2O2溶液浓度标定。可选用 (填标号)试剂对H2O2溶液进行滴定,测定其浓度。
A.H2C2O4 B.KMnO4 C.淀粉KI
②装置气密性检查。打开止水夹,将注射器b的活塞推至底部,拉动注射器a活塞吸入10 mL空气,关闭止水夹。向下推动注射器a活塞至底,当观察到注射器b的现象为,说明装置的气密性良好。
①在反应室中加入适量MnO2 , 将注射器b活塞推至底部,关闭止水夹。用注射器a准确抽取cmol.L-1 H2O2溶液Vl mL,缓慢地注入反应室后,固定注射器a活塞。
②反应结束后,待反应体系处于状态时,读取注射器b的气体体积为V2 mL,则产生O2的体积为mL。
③设室温下O2的密度为ρ g.L-1 , 一个O2实际质量为mg,则NA=(用含ρ等字母的代数式表示)。

已知:①草酸钴晶体难溶于水
② 为有机物(难电离)
③相关金属离子 形成氢氧化物沉淀的
范围如下:
| 金属离子 | | | | |
| 开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
| 沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |

已知:①常压下过氧化氢和水的沸点分别是158℃和100℃。
②过氧化氢易分解,温度升高会加速分解。
③双氧水和冰醋酸反应放出大量的热。
①蛇形冷凝管的进水口为。
②向蛇形冷凝管中通入60℃水的主要目的是。
③高浓度的过氧化氢最终主要收集在(填圆底烧瓶A/圆底烧瓶B)。
①向冰醋酸中滴加提浓的双氧水要有冷却措施,其主要原因是。
②磁力搅拌4h的目的是。
①滴定时所选指示剂为,滴定终点时的现象为。
②过氧乙酸与碘化钾溶液反应的离子方程式为。
③制得过氧乙酸的浓度为mol/L。

实验过程中,观察到浸有酚酞溶液的滤纸变红,装置 B 中澄清石灰水变浑浊,说明分解产物中含有(填化学式);若观察到,说明分解产物中含有 CO。草酸铵分解的化学方程式为。
取 20.00 mL 血液样品 ,定容至 l00m L, 分别取三份体积均为25.00 mL 稀释后的血液样品,加入草酸铵,生成草酸钙沉淀,过滤,将该沉淀溶于过量稀硫酸中,然后用 0.0l00mol/L KMnO4 溶液进行滴定。滴定至终点时的实验现象为。三次滴定实验消耗 KMnO4 溶液的体积分别为0.43mL , 0.41 m L , 0.52mL, 则该血液样品中钙元素的含量为m mol/L。


①实验室也可用 B 装置制备 NO,X装置的优点为
②检验装置气密性并装入药品,打开K2 , 然后再打开K3 , 通入一段时间气体,其目的是,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
①设计实验证明 HNO2是弱酸:。(仅提供的试剂:1 mol•L-1盐酸、1mol•L-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是,亚硝酰氯(ClNO)的质量分数为。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10 , Ksp(Ag2CrO4)=1×10-12)
气体产物成分的探究。小组成员采用如图装置进行实验:
A.  B.
B.  C.
C.  D.
D.  E.
E. 
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→→尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2 , 其目的为。
③实验证明了气体产物中含有CO,依据的实验现象为。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2 , 其目的是。
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4 , 再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
步骤2中滴定终点的现象为;步骤3中加入锌粉的目的为。

用离子方程式表示过程②中稀硝酸的作用:。
Ⅱ.由FeCl3·6H2O制得干燥FeCl2的过程如下所示:
①向盛有FeCl3·6H2O的容器中加入SOCl2 , 加热,获得无水FeCl3;
②将无水FeCl3置于反应管中,通入过程①中产生的气体一段时间后加热,生成FeCl2;
③收集FeCl2 , 保存备用。
Ⅲ.测定FeCl2的含量。
分析方法:①取a g样品配制成100 mL溶液;②用移液管吸取所配溶液5.00 mL,放入500 mL、锥形瓶内并加水200 mL;③加硫酸锰溶液20.00mL,用0.1 mol/L酸性高锰酸钾标准溶液滴定,终点时消耗酸性高锰酸钾标准溶液V mL。