反应Ⅰ:
反应Ⅱ:
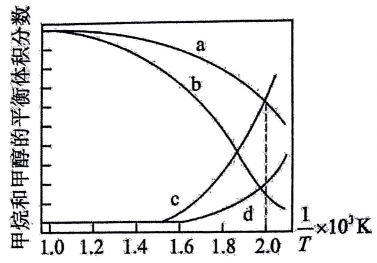
在密闭容器中通入和
, 假设只发生反应Ⅰ和Ⅱ,分别在
和
下进行反应,其中
和
的平衡体积分数随温度变化如图所示。
已知:对于反应Ⅱ,为速率常数,只与温度有关,分压
总压
物质的量分数。下列说法不正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )


A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能


上述平衡时 , 向体系通入
气,重新达到平衡时,
, 则ab(填“>”“<”或“=”)。(已知反应
的
, 物质
的摩尔分数
)
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
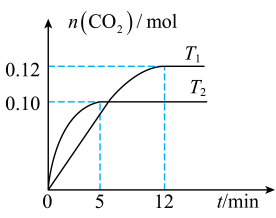
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=,该条件下的平衡常数K=。
②第15 min后,温度调整到T2 , 数据变化如上表所示,则T1 T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=。
反应Ⅰ:
反应Ⅱ:
①该条件下,与
反应生成
的热化学方程式为.
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中的物质的量分数在不同温度(
、
、
)随压强的变化如图所示。
则曲线对应的温度是,
点平衡常数
的大小关系是。
①下列各项中能说明该反应已达到化学平衡状态的是。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
②时刻反应达到平衡,若
, 计算
内的平均反应速率
,此时
的转化率为。
③反应温度时,画出
时段,
随
变化曲线。保持其他条件不变,改变反应温度为
, 再次画出
时段,
随
变化趋势的曲线。(在答题卡方框中完成)
上述反应在常温下(填“能”或“不能”)自发进行。
第一步:
第二步:
写出工业上以、
为原料合成尿素的热化学方程式:。
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:

Ⅰ.合成甲醇:
;
;
Ⅱ.逆水煤气反应:;
;
Ⅲ.成气合成甲醇:;
;
回答下列问题:
①基态的3d电子轨道表示式为。
② ,
(用
,
表示)。
物质的量/mol |
|
| |||||
0 | 5min | 10min | 15min | 20min | 25min | 30min | |
8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 | |
①在℃条件下5-10min内,以
表示的该反应速率
,该条件下的平衡常数K=。
②下列说法正确的是。
A.
B.混合气体的密度保持不变时,说明反应Ⅰ已达到平衡
C.平衡时向容器中充入惰性气体,反应Ⅰ的平衡正向移动
D.加入适当催化剂,可加快反应速率
温度(K) | 催化剂 |
| 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对的转化为
的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为(填字母符号)。
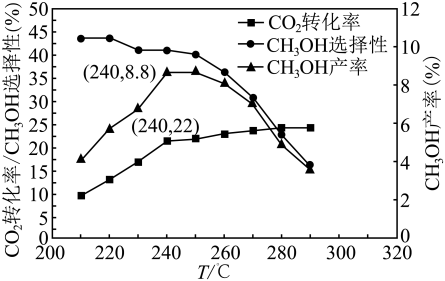
①转化率随温度升高而增大的原因可能是。
②选择性随温度升高而减小的原因可能是。
A.升高温度B.通入惰性气体C.增加乙烷浓度D.加入催化剂

[乙烯选择性;乙烯收率=乙烷转化率×乙烯选择性]
下列说法正确的是____。

回答下列问题:
Ⅰ.已知NO和经反应Ⅰ和反应Ⅱ转化为
, 其能量变化如图所示:

Ⅰ.
, 平衡常数
;
Ⅱ.____ , 平衡常数
;
a.升高温度 b.缩小容器体积 c.加入催化剂

T/℃ | 200 | 300 | 400 |
K | 0.5 |
请回答下列问题:
试比较、
的大小,
(填“>”、“=”或“<”)。

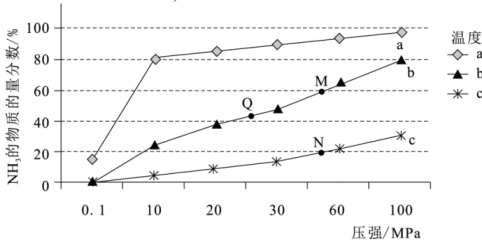
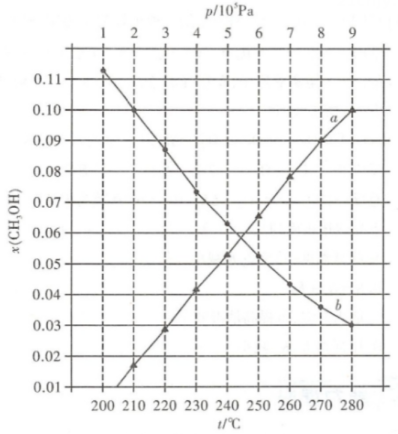
①随压强增大,的体积分数增大的原因是。
②比较b点和a点:平衡常数
(填“>”、“=”或“<”,下同),
的浓度
。
③计算b点的平衡常数(用分压表示的平衡常数,结果保留2位有效数字)
时间 | |||||
0 | 0.50 | a | 0.75 | 0.75 | |
1 | 0.50 | 0.35 | 0.25 | 0.25 |
①内,
。
②末时,混合气体中
的物质的量分数为。已知:B的物质的量分数
。
③第时
第
时
(填“>”、“<”或“=”)第
时,
(填“>”、“<”或“=”)
a.容器内气体的密度不再变化
b.容器内气体的平均相对分子质量不再变化
c.的体积分数不再变化
d.断裂个
键的同时生成
个水分子
I:
II:
III:
条件 | 保持温度为 | ||||||
时间 | 0 | 5min | 10min | 15min | 20min | 25min | 30min |
| 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
| 0 | 0.3 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
①内,以
表示的该反应速率
,最终达平衡时
的转化率
,该温度
℃下的平衡常数
。
②保持温度℃不变,向该
密闭容器中加入该四种反应混合物各
, 该时刻,正、逆反应速率的大小关系为:
(填“>”“<”或“=”)。
①CO2(g)+4H2CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g)CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g)CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
物质 | H2(g) | O2(g) | CO(g) | CO2(g) | H2O(g) | CH4(g) |
标准摩尔生成焓(kJ·mol-1) | 0 | 0 | -110.5 | -393.5 | -241.8 | -74.81 |
①当CO的平衡转化率为时,反应条件可能是。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是。
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO2的量
某温度下,向 2 L 的密闭容器中充入 N2和 O2各 1 mol,5s 后 O2的物质的量为 0.4 mol, 则 0~5s 内 NO 的反应速率mol·L-1·min-1。
 B .
B .  C .
C . 
序号 | |||
I | 0.10 | 0.10 | 0.15 |
Ⅱ | 0.20 | 0.20 | 2.40 |
Ⅲ | 0.20 | 010 | 1.20 |

①物质D的聚集状态为。
②a、b、c三点气体C的逆反应速率由大到小的顺序为(用a、b、c表示)。
③T2时,此反应的平衡常数K=(不写单位)。
反应①2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH1 K1
反应②2NO(g)=N2(g)+O2(g) ΔH2=-180.5kJ/mol K2=1×1030
反应③CO2(g)CO(g)+
O2(g) ΔH3=+283.0kJ/mol K3=2×10-46
则298K时,反应①ΔH1=kJmol;K1=;
| 时间/min | 0 | 30 | 60 | 120 | 180 | |
| T℃ | CO的分压/kPa | 4 | 8.8 | 13 | 20 | 20 |
| N2的分压/kPa | 48 | 45.6 | 43.5 | 40 | 40 | |
T℃时,反应①的Kp=(kPa)-1。
A.使用催化剂 B.增大压强 C.增大反应物浓度 D.减小生成物浓度

②673K时,合成氨反应机理中各步反应的能量变化如图所示,其中吸附在催化剂表面上的粒子用“*”标注。
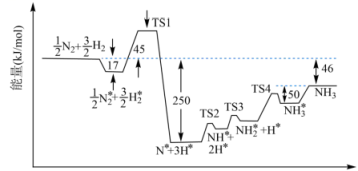
图中决速步骤的反应方程式为。
①
②
写出NH3还原NO至N2和水蒸气的热化学方程式。
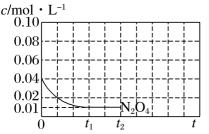
。已知该反应的正、逆反应速率方程分别为
、
, 其中
、
分别为正、逆反应速率常数,变化曲线如左下图所示,则该反应的反应热
O(填“>”、“<”或“=”),写出推理过程
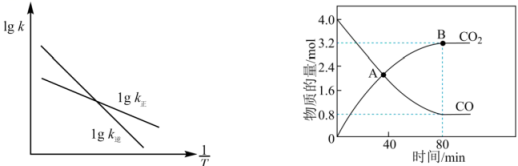
①在A点时,N2O的生成速率N2的生成速率(填“>”、“<”或“=”)。
②若平衡时总压强为p kPa,用平衡分压代替其平衡浓度表示的化学平衡常数(平衡分压=总压×物质的量分数)。
第一步:;第二步:
若第一步为快反应,下列示意图中能体现上述反应过程能量变化的是____(填标号).
 B .
B .  C .
C .  D .
D . 
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | |
0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为.
②上述反应中,正反应速率为 , 逆反应速率为
, 其中
、
为速率常数,则
为(以K和
表示).若
, 在
时,
.
③由上述实验数据计算得到:和
的关系可用下图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为、(填字母).

A. B.
C.
D.
A. B.
C.

①
②
相关物质的化学键键能数据如下:
化学键 | |||||
703 | 355 | 465 | 516 | 583 |
试计算该反应.
①可用、
、
、
表示该反应的平衡常数,其表达式为
;
②已知:上述反应的平衡常数的对数随温度的变化如图所示,在温度为
时此反应在
点达到平衡。若升高温度,B、C、D、E四点中能正确表示该反应的
与
的关系的点为.

0 | 10 | 20 | |
2.5 | 1.5 | 1.3 |
①内,用
来表示的平均化学反应速率为;
②在此温度下,于恒容密闭容器中充入进行此反应,能说明该反应已达到化学平衡状态的是(填字母)
a.
b.和
的浓度之比保持不变
c.在绝热容器中,反应的平衡常数不再变化
d.容器内气体的平均相对分子质量为45,且保持不变


①反应ⅰ在(填“较低”或“较高”)温度下才能自发进行。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式:.
③(计算结果保留两位有效数字,已知
)。


图中表示的平衡转化率的曲线是(填“
”“
”或“
”),简述判断方法:.

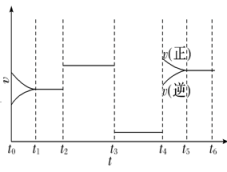
2A(g)+B(g)3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
①t3时改变的条件为,t4时改变的条件为。
②a(填“>”或“<”)0。

