
天青石主要元素质量分数如下:
元素 | |||||
质量分数( | 36.4 | 2.0 | 4.0 | 0.5 | 5.0 |
。
回答下列问题:
A. B.
C.
D.
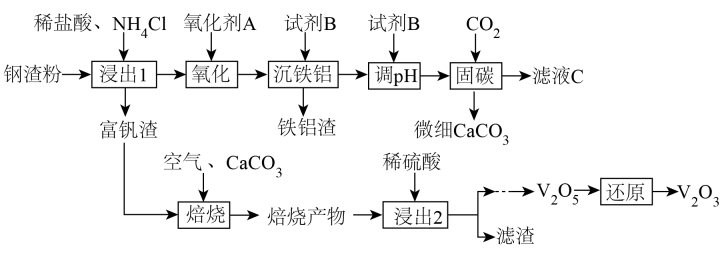
已知钢渣中元素质量分数为
在稀盐酸和
混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的
如下表所示:
金属离子 | ||||
开始沉淀的 | 1.9 | 7.2 | 3.5 | 12.4 |
沉淀完全的 | 2.9 | 8.2 | 5.1 | 13.8 |
回答下列问题:




已知:①软锰矿与黄铁矿的主要成分分别为、
, 还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
金属离子 | |||||
开始沉淀的pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全( | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
回答下列问题:
滤渣1的主要成分为S、,加入后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:。


已知:①25℃时,相关金属离子形成氢氧化物沉淀的
范围如下:
金属离子 | |||||
开始沉淀的 | 6.3 | 1.8 | 3.4 | 6.9 | 7.1 |
沉淀完全的 | 8.3 | 3.2 | 4.7 | 8.9 | 9.1 |
②氧化前后,溶液中、
元素的化合价均为+2价。


相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | |||||||
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
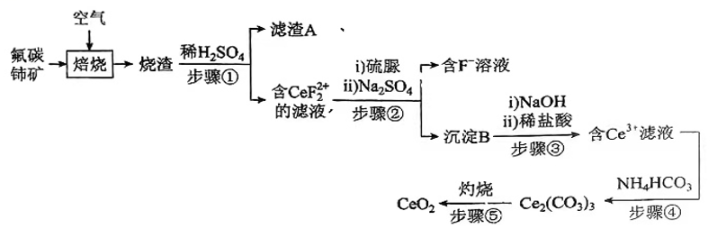
已知:①稀土离子易与SO42-形成复盐沉淀,Ce3+和SO42-发生反应:;
②硫脲:具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+ , 两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
该工艺条件下金属离子开始沉淀和完全沉淀(c≤10-5mol/L)的pH如表所示:
金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
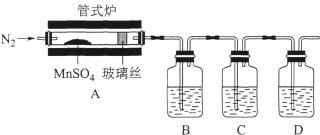
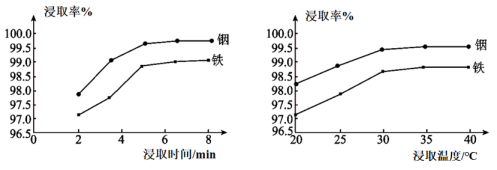
①装置B、C、D中的溶液依次为(填字母)。
a.Ba(NO3)2b.BaCl2c.品红 d.浓硫酸e.Ca(OH)2 f.NaOH
②实验结束时,为防止倒吸,正确的操作方法是。
①计算产品中MnSO4的质量分数(保留两位有效数字)。
②为提高测定的精度,应补充的实验操作。

已知:①200℃下氧化焙烧,钕铁硼废料中钕和铁主要以和
的形式存在,硼常温下稳定,加热至300℃被氧化,不与稀酸反应.
②易与
形成多种配合物离子,易与
形成
沉淀.
回答下列问题:


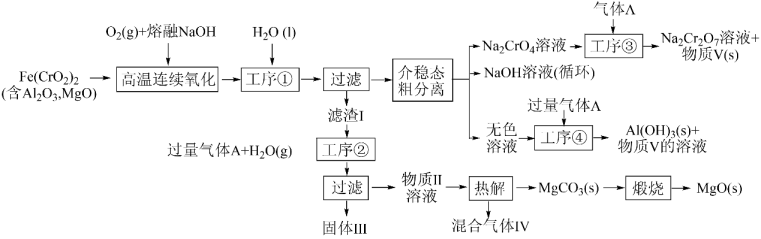
回答下列问题:


已知:常温下;
为第四周期第ⅤA族元素;高铼酸铵微溶于冷水,易溶于热水.
回答下列问题:

图1:高铼酸铵谱 图2

已知:①部分金属硫化物的Ksp (25℃)为Ksp(FeS)=6.3×10-18、Ksp(CuS)=6.3×10-36。
②当溶液pH>12时,Cr(OH)3会转化为CrO2-。
回答下列问题:

已知:①P2O4为磷酸酯萃取剂;②Sc3+易水解;③Ksp[Sc(OH)3]=8.00×10-31。
请回答下列问题:
试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
1-1 | 1 | 分相快 | 90.76 | 15.82 |
1-2 | 2 | 分相容易 | 91.53 | 19.23 |
1-3 | 3 | 分相容易 | 92.98 | 13.56 |
1-4 | 4 | 有第三相 | 90.69 | 30.12 |
1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |


①硫离子的配位数为。
②2号原子的坐标为。
③该晶体的密度为。
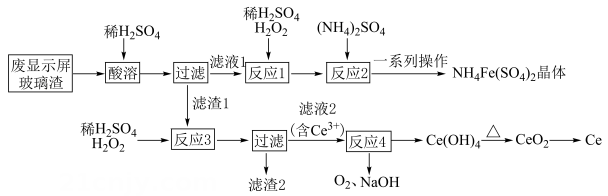
已知:不溶于稀硫酸,也不溶于
溶液。
回答下列问题:
①溶液 ②
溶液 ③
溶液
①反应Ⅲ的化学方程式为。
②加入转化为
的离子方程式为。

已知:为强电解质;P2O4为磷酸二异辛酯。
回答下列问题:

已知:①HR为有机萃取剂,难溶于水,可萃取Fe3+ , 萃取时发生![]() 反应可表示为:Fe3++3HR
反应可表示为:Fe3++3HRFeR3+3H+;
②常温时,1mol·L-1LiOH溶液的pH=14。
回答下列问题:
 , 该分子中可能与Fe3+形成配位键的原子有。
, 该分子中可能与Fe3+形成配位键的原子有。

①基态Co原子核外电子排布式为。
②该晶胞密度为 g·cm-3。(写出计算式,阿伏加德罗常数为NA)
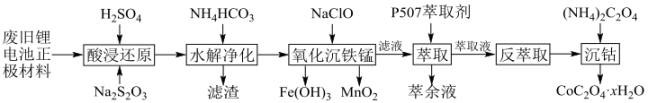
已知该工艺条件下,有关金属离子沉淀完全的pH见下表:
离子 | ||||||
pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
回答下列问题:

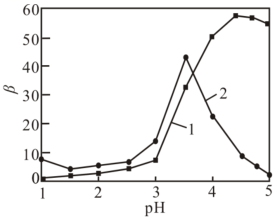
图1 水相pH对萃取率的影响 图2 水相pH对分离因素的影响
由图可知,萃取时的最佳水相pH为____(填字母)。
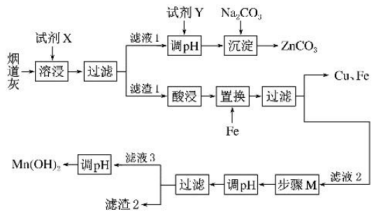
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示.
金属离子 | |||
开始沉淀的 | 7.0 | 1.9 | 8.1 |
完全沉淀的 | 9.0 | 3.2 | 10.1 |
②的化学性质与
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数
与
的关系如图所示。
回答下列问题:
石墨电极反应式为.

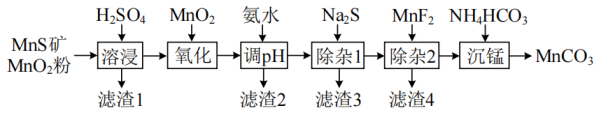
相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | | | | | | | |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |

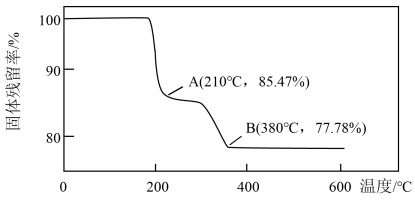
①写出从开始加热到A点过程中发生反应的化学方程式。
②若D点对应的固体残留率为64.52%,写出D点残留固体的成分及物质的量之比。

已知:①常温相关氢氧化物的值如下:
物质 | | | | | | |
| | | | | | |
②酸性条件下极难被氧化。

A. B.
C.
D.


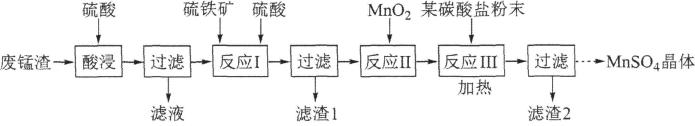
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是,宜选用(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是。

①钕的活动性较强,能与酸发生置换反应,其稳定的化合价为价;
②某些金属氢氧化物沉淀完全时的如下表所示:
沉淀 | ||||||
沉淀完全的 | 5.2 | 3.2 | 9.4 | 9.5 | 10.1 | 8.5 |
回答下列问题:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图甲中原子A的坐标为 , B为
, 则C原子的坐标为。
②若阿伏加德罗常数的值为 , 则晶体密度为
(列出计算式)。

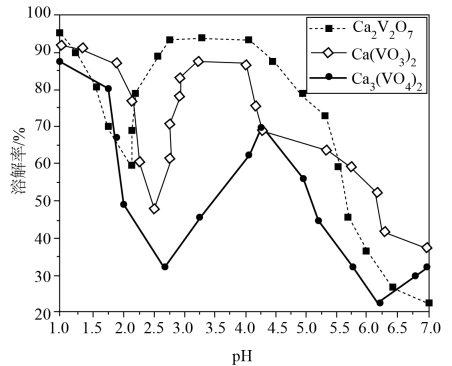
已知:i.部分含钒物质常温下在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
ii.VO+ 2 OH-
VO
+H2O
回答下列问题:

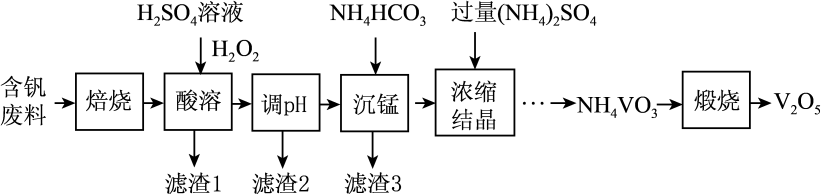
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10−20 | 4×10−14 | 1.9×10−33 |

已知:时相关物质的
如下表:
物质 | ||||
回答下列问题:

离子 | |||||
0.601 | 0.15 | 0.3 | 0.001 | 0.1 |
①、稀硫酸、
发生总反应的离子方程式为。
②反应过程中硫酸不能过量太多的原因是。
