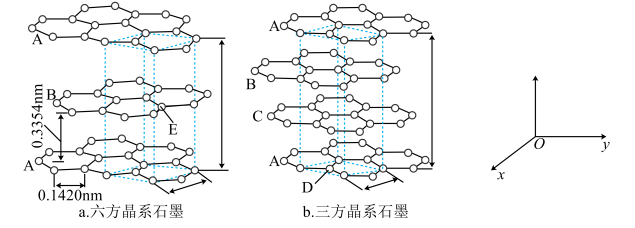
②将HNO3与SO3按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是。比较氧化性强弱:
HNO3(填“>”、“<”或“=”);写出A中阴离子的结构式 。

①晶胞中有4个面的面心由钒原子占据,这些钒原子各自周围紧邻的锑原子数为。锑和磷同族,锑原子基态的价层电子排布式为。
②晶体中少部分钒原子被其它元素(包括Ti、Nb、Cr、Sn)原子取代,可得到改性材料。下列有关替代原子说法正确的是。
a.有或
价态形式 b.均属于第四周期元素
c.均属于过渡元素 d.替代原子与原离子的离子半径相近

晶胞中的个数为。已知
的摩尔质量是
, 阿伏加德罗常数为
, 该晶体的密度为
。
| 物质 | 熔点/℃ |
| | 800.7 |
| | |
| | |
| | |
与
均为第三周期元素,
熔点明显高于
, 原因是。分析同族元素的氯化物
、
、
熔点变化趋势及其原因。
的空间结构为,其中
的轨道杂化形式为。

A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是。

①H2O分别与Fe2+、 的相互作用分别为、。
②比较中的键角∠O−S−OH2O中的键角∠H−O−H。 (填“<” “>”或“=”)





![]()


①阿伏加德罗常数的值为NA , 则该晶体密度为g·cm-3.(用含a,NA的表达式表示)。
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,Ni-N键中离子键成分的百分数小于Ni-O键,原因是。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为;N所替代的O的位置可能是。
①基态氮原子的电子排布图为。
②上述涉及的元素H、B 、C、N、O中电负性最大的是(填元素符号)。

①上述三种物质中,沸点最高的是(填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是(填“①”或“②” )号氮原子。


①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
①的一种配合物的化学式为
, 其中
原子的配位数为,
中C原子的杂化类型为。
②均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
元素 | |||
电离能 | 717 | 759 | |
1509 | 1561 | ||
3248 | 2957 | ||
锰元素位于第四周期第VIIB族。比较两元素的 , 可知,气态
再失去1个电子比气态
再失去1个电子难,对此你的解释是。

①![]() 和
和![]() 中所有原子均共面,其中氮原子较易形成配位键的是。
中所有原子均共面,其中氮原子较易形成配位键的是。
②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3 , 配体SCN-中提供孤电子对的原子是(填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
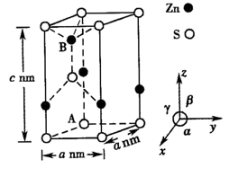
①该晶体中,锌的配位数为。
②已知空间利用率 , 设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为。

回答下列问题:

A.![]() B.
B.![]()
C.![]() D.
D.![]()

FeSO4•7H2O中H2O与Fe2+、H2O与SO的作用力类型分别是、。H2O中H-O-H的键角SO
中O-S-O的键角(填“>”“<”或“=”)。
①从该晶胞中能分割出来的结构图有(填标号)。
a. b.
b. c.
c. d.
d. e.
e.
②已知该晶体密度为ρg•cm-3 , NA为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有个,该距离为pm(用含ρ和NA的代数式表示)。



 )中同周期三种元素电负性由大到小的顺序为,氮原子的杂化方式为,C=N与C-C键夹角C=N与N-O键夹角(填“<”“>”或“=”)。
)中同周期三种元素电负性由大到小的顺序为,氮原子的杂化方式为,C=N与C-C键夹角C=N与N-O键夹角(填“<”“>”或“=”)。

一个T-碳晶胞中含有个碳原子。 T-碳的密度非常小,是金刚石的一半,则T-碳晶胞的棱长和金刚石晶胞的棱长之比为。
①Fe2+的价层电子排布式是。
②乳酸分子(![]() )中 σ 键与π键的数目比为。
)中 σ 键与π键的数目比为。
③乳酸亚铁中各元素的电负性由大到小的顺序为。
④C与O中,第一电离能较大的是, O的第二电离能远大于第一电离能的原因是。
①[Fe(NH3)6]Cl2中Fe2+的配位数为。
②NH3的空间构型是,其中N原子的杂化方式是。

①该超导材料的化学式是。
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=g·cm-3。(用 NA表示阿伏加德罗常数,写出计算表达式即可)
③该晶胞在xy平面投影如图2所示,将图2补充完整。

A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6 , 其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于分子(填“极性”或“非极性”),分子中Al采取杂化。


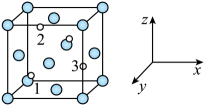
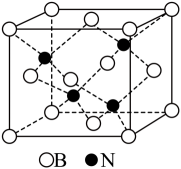
①六方相氮化硼结构与石墨相似,但是却不导电的原因是。
②立方相氮化硼中,离硼原子最近且等距离的硼原子有个。
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm=m3·mol-1 (列出计算式)。

已知:A为间隔的阳离子,例如、
等;A'为单一组分钙钛阳离子,例如
、
、
等;B为单一组分钙钛矿中心离子
、
等,X为单一组分钙钛矿的阴离子,例如
、
或
等卤素离子。
回答下列问题:
 )反应的部分历程为
)反应的部分历程为 。
。①乙酰氯分子中碳原子的杂化类型为。
②乙酰氯分子中C-C键与C-Cl键的夹角 120°(填“大于“等于”或“小于”), 判断理由是。
③的空间构型为。

物质 | 肼 | 偏二甲肼 |
熔点 | 1.4℃ | -58℃ |
沸点 | 113.5℃ | 63.9℃ |
二者熔沸点差异较大的主要原因是。
a.![]() b.
b.![]() c.
c.![]()
的结构如图1所示。

①和
之间的作用力类型为。
②的
大于
的
, 从结构角度解释原因:。

①由于的空间构型为,且磷氧键键能较大,锂离子嵌入和脱出时,磷酸铁锂的空间骨架不易发生形变,具有良好的循环稳定性。
②正极材料在和
之间转化时,经过中间产物
。
转化为
的过程中,每摩晶胞转移电子的物质的量为摩。

①基态As原子的核外电子排布式为[Ar]。
②雌黄中As—S—As键角(填“大于”“小于”或“等于”)S—As—S键角。
③雄黄和雌黄比砷的氧化物的毒性要小很多,除结构稳定性的原因之外,从物理性质的角度分析,还与其有关。
①青金石的结构中、S2-代替了方钠石中部分Cl—的占位,Ca2+代替了部分Na+的占位,则方钠石的化学式为。
②青金石中第三周期各元素的第一电离能由大到小的顺序为。
③青金石的颜色与骨架内填入的阴离子有关,其中一种重要阴离子是三硫自由基阴离子。研究表明,三硫自由基阴离子(II)可以通过多硫阴离子S(I)在高温下的均裂反应得到,并最终可能异构化为另一种S
的异构体(III),过程如下图:

关于I、II、III三种物质,下列说法正确的有(填字母)。
A.I中的S—S键都是σ键
B.II中的S原子最外层都满足8电子稳定结构
C.II的中心硫原子的杂化轨道类型为sp
D.与II互为等电子体
E.III一定为平面形结构

①该方解石结构中阴离子的空间构型为。
②设NA为阿伏加德罗常数的值,则该方解石晶体的摩尔体积Vm=m3•mol-1(列出算式)。
A.配位键 B.离子键 C.共价键 D.氢键
 )在水中的溶解度远大于在苯中的溶解度,可能原因是
)在水中的溶解度远大于在苯中的溶解度,可能原因是①吡啶和H2O均为极性分子,而苯为非极性分子;
②。
吡啶及其衍生物(![]() 、
、 )的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
)的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。


a.1s²2s²2p²3p¹ b.1s²2s²2p4 c.1s²2s²2p²3s¹ d.1s²2s²2p³
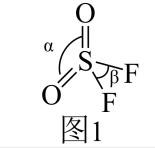
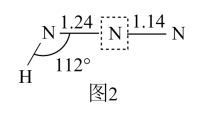
已知:①典型N-N、N=N和N≡N的键长分别为1.40×10⁻10m、1.20×10⁻10m和1.09×10⁻10m;②甲酸根的两个碳氧键键长相同,处于典型碳氧单键键长和碳氧双键键长之间,其结构可以用两个极端电子式( )的平均杂化体来表示。试画出HN3分子的两个极端电子式;“
)的平均杂化体来表示。试画出HN3分子的两个极端电子式;“![]() ”中N原子的杂化方式为。
”中N原子的杂化方式为。
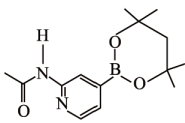
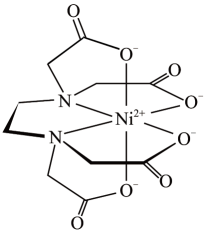
1个该配合物中通过螯合作用形成的配位键有个,在形成配位键前后C-N-C键角将(填“增大"“减少”或“不变”)。

①与Co同周期,基态原子有1个未成对电子的元素有种。
②配离子的空间构型为,钴元素价态为,通过整合作用形成的配位键有个。
③配合物A无顺磁性,则中心离子的杂化方式为(填标号)。(若中心离子具有单电子,则配合物为顺磁性物质。)
A. B.
C.
D.
④咪唑(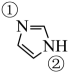 )具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。
)具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。
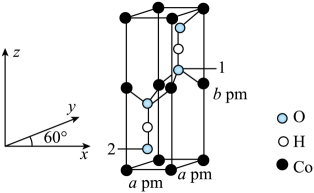
已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为。为阿伏加德罗常数的值,该晶体的密度为
(用计算式表示)。
基态Cu原子价层电子轨道表示式为 ,其原子核外电子占据的最高能层符号为。
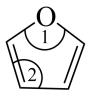 中∠1(填“>”、“<”或“=”)∠2。
中∠1(填“>”、“<”或“=”)∠2。
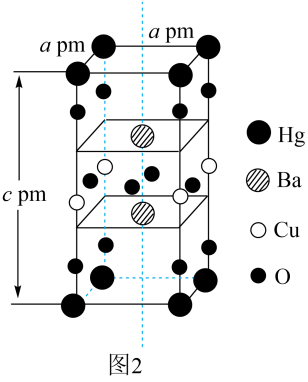
该晶胞中O、Cu、Ba、Hg原子的个数比为。