















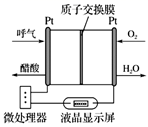



回答下列问题:
①在测体温时,电池将 转化为(填“化学能”或“电能”) 。
②电池中电子的流向:由 到(填化学式),负极的电极反应式为。

| 实验方案 | 实验现象 |
| | i.溶液先变黄色,迅速变为棕色 ii.将棕色溶液加热,颜色变浅,冷却 |
资料:FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0
在冷却后的溶液中滴加(填“试剂和现象”),说明有Fe3+生成。从而证明Fe2+可以还原NO 。
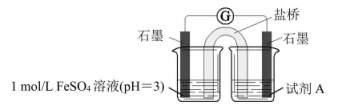
①右侧烧杯中试剂A是。
②实验证据是。

|
实验 混合溶液 |
A |
B |
C |
D |
E |
F |
|
4mol•L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中: V2=,V6=,V10=。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
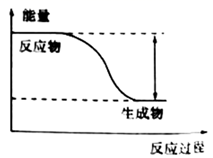
①该反应为(填“吸热”或“放热”)反应。
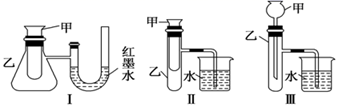
②如图三个装置中,不能证明“铁与稀硫酸反应是吸热反应还是放热反应”的是。
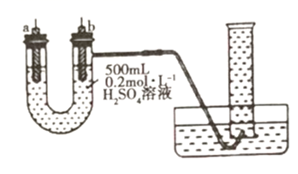
①若a、b极不用导线相连,则b极材料为(填“纯铁片”或“纯铜片”)。当收集到 (已折算为标准状况,且溶液体积不变)气体时,用时
,则用
表示的平均反应速率为
。
②将a、b极(a极为“纯铁片”,b极为“纯铜片”)用导线相连,则电子在导线上的流动方向为从到(填“a极”或“b极”,下同);此时a极的电极反应式为,当收集到 (已折算为标准状况)气体时,用时
。
③根据上述实验所得结论为。
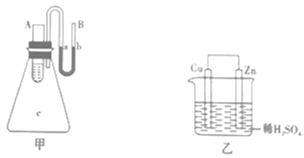
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子的流动方向,从Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生H2为0.5mol;
⑥正极的电极反应式为Zn-2e-=Zn2+。
以上描述合理的是(填序号)。
①若图乙的烧杯中最初装入的是500mL2mol·L-1的稀硫酸,当原电池工作2min时共收集到11.2L氢气(标准状况),则这2min内H2SO4的反应速率v(H2SO4)=。2min末,烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=、c(ZnSO4)=。
②若要使反应Zn+H2SO4=ZnSO4+H2↑的速率加快,下列措施可行的是(填序号)。
a.改锌片为锌粉
b.改稀H2SO4为98%的浓硫酸
c.升高温度
d.滴加少量CuSO4溶液
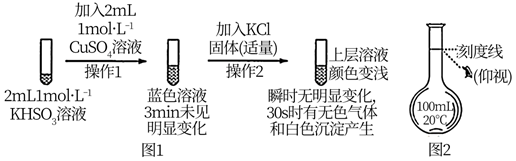
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:

①K闭合时,一段时间后指针几乎归零。
②向U型管右管添加,a电极为极,产生的现象证实了其推测,其中不同于图1操作2后的现象是。
已知:同浓度的稀溶液中氧化性: 。
| 实验 | 现象 | |||
| | 编号 | 溶液X | ||
| Ⅰ | | 1小时内溶液颜色始终保持无色 | ||
| Ⅱ | | 溶液黄色立即加深,30s后溶液变为褐色,无浑浊 | ||
| Ⅲ | | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有 | ||
| Ⅳ | | 迅速变浑浊,离心分离后上层溶液为无色(经检测无 | ||

实验结论:在反应体系中,各物质的浓度对氧化还原反应的发生有一定的影响。

①v(N2)=3mol·L-1·min-1
②v(H2)=6mol·L-1·min-1
③v(NH3)=4.5mol·L-1·min-1
其中表示该反应的反应速率最快的是(填标号)。

①电极A是(填“正极”或“负极”),电极B的电极反应式为。
②若外电路中转移2mol电子,则该燃料电池理论上消耗的O2的体积(在标准状况下)为L。


①上述过程中,能量的变化形式是由转化为。
②根据数据计算,分解1molCO2需(填“吸收”或“放出”)kJ的能量。

①Pt电极(a)为极(填“正”或“负”);Pt电极(b)上的电极反应式为:。
②该过程总反应的化学反应方程式为,反应一段时间后,KOH溶液的浓度将(填“增大”“减小”或“不变”)。当消耗0.1 mol O2时,理论上转移电子个数为;

①在恒温恒容下,下列叙述能说明该反应已达到化学平衡状态的是(选填字母序号)。
a.容器内压强不再发生变化
b. 的体积分数不再发生变化
c.容器内气体原子总数不再发生变化
d.相同时间内消耗 的同时消耗
②一定温度,向容积为 的容器中加入一定量
和
,
后生成
,则用
表示该反应的速率是。


①该反应的化学方程式为。
②反应开始至2min时,Y的平均反应速率为。
③2min时,v正(填“>”“<”或“=”)v逆。
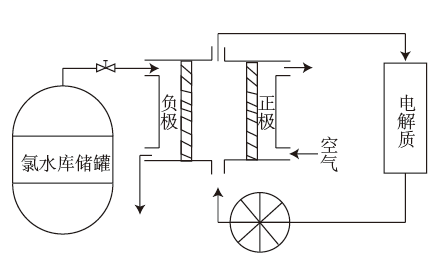
a.电解法b.还原法c.热分解法d.物理方法

写出该装置的电极反应式。负极:;正极:。