







下列说法正确的是







向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有.
针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是,操作现象是.
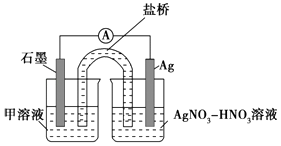
Ⅰ.
Ⅱ.
①下列操作中,能提高平衡转化率的是 (填标号)。
A.增加用量 B.恒温恒压下通入惰性气体
C.移除 D.加入催化剂
②恒温恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,的转化率为
,
的物质的量为
, 则反应Ⅰ的平衡常数
(写出含有α、b的计算式;对于反应
,
, x为物质的量分数)。其他条件不变,
起始量增加到
, 达平衡时,
, 平衡体系中
的物质的量分数为(结果保留两位有效数字)。


已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
②的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 Mn2+;在中性和弱碱性溶液中,被还原为 MnO2;在强碱性溶液中,被还原为
。

连接电压表,形成闭合回路,电极 B 应和图中电压表的极(填“a”或“b”)柱相连,测得初始电压为 V1。
实验操作和读数记录如下:
左烧杯(Na2SO4/Na2SO3) | 右烧杯(KMnO4 , 调 pH=4) | 电压表读数变化 | |
① | ①逐滴加入5 mL 0.05 mol/L H2SO4 | 由V1逐渐降低 | |
② | ② 逐滴加入5 mL 0.1 mol/L NaOH | 由V1逐渐升高 | |
③ | 逐滴加入5 mL 0.05 mol/L H2SO4 | 由V1逐渐升高 | |
④ | 加入少量 0.1 mol/L NaOH | 由V1略微下降 | |
① | 继续逐滴加入NaOH至5 mL | 再迅速下降 |
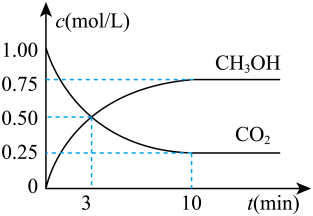
①计算3 min内用氢气表示的该反应的反应速率;3 min时,正反应速率逆反应速率(填“>”“=”或“<”)。
②10 min反应达平衡,氢气的转化率为。当反应达平衡后,维持温度和压强不变,改变其它条件使反应速率增大,采取的措施(写一条即可)

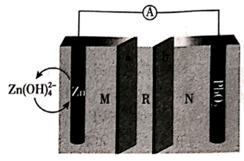
①甲烷进口为极(左图),Pt(b)电极发生反应(填“氧化”或“还原”)。
②以石墨做电极电解饱和食盐水(滴有酚酞),如图所示。电解开始后在的周围(填“阴极”或“阳极”)先出现红色。该极的电极反应式为。


①该离子交换膜为(填“阳”或“阴”)离子交换膜。
②电池负极反应式为。
③当电路中转移0.2 mol电子时,理论上消耗标准状况下O2的体积为L,需补充物质X的化学式为。
kJ/mol
写出与
反应生成
和水蒸气的热化学反应方程式。



若以铅酸蓄电池为直流电源,则铅酸蓄电池中极的电极反应式为。
已知:。
①副产物可能是(写出一种即可)。
②标准状况下,当阳极生成氧气的体积为时,测得整个阴极区内的
, 电解效率为(忽略电解前后溶液的体积变化)。

放电时,向(填“
极”或“
极”)移动;甲池中正极的电极反应式为。



①由此可知溶液呈(填“酸性”或“碱性”)
②写出在水中存在的两个平衡:ⅰⅱ。
这两个平衡程度的大小关系是:ⅰⅱ。(填“<”或“>”)
其中甲同学设计图1装置(盐桥中为KCl),闭合开关后灵敏电流计指针发生偏转。

①通过验证新产物也可以帮助确认正、负两极,验证电源正极生成物的实验操作方法是。
②闭合开关后盐桥中的移向(填“左”或“右”)侧的烧杯。
③负极的电极反应。
④乙同学按图2操作,并没有出现预期的现象,而是溶液很快呈红色。大约30mm后红色变为橙色,5小时后变为黄绿色。
因此,乙认为刚开始一段时间并不涉及氧化还原反应。
查阅资料:溶液中、
、
三种微粒会形成一种组成为
的“配合物”并存在转化关系:
请从反应速率和平衡的角度解释原因。

混合动力车上坡时利用电池放电提供能源。
①电极A是(填“正极”或“负极”)。
②正极的电极反应式为。

转化过程中所用和NaOH溶液通过电解
溶液获得,装置如图2。
已知:阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。

图2中,电极C为电解池的(填“阴极”或“阳极”)。

序号 | ① | ② | ③ | ④ |
滴入试剂 | AgNO3溶液 | 淀粉KI溶液 | KSCN溶液 | K3[Fe(CN)6]溶液 |
实验现象 | 产生沉淀 | 无蓝色出现 | 无红色出现 | 无蓝色沉淀 |
供选择的实验用品:FeCl2溶液,CuSO4溶液,铜棒,锌棒,铁棒

实验现象:。