

反应Ⅰ:
反应Ⅱ:
恒压下,时,甲醇产率随温度的变化如图所示(分子筛膜能选择性分离出
)。下列关于该实验的说法不正确的是( )

历程ⅰ:
历程ⅱ:
历程ⅲ:
历程ⅳ:

如图所示为在体积2L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过5min反应,测得甲醇转化率与甲醛的选择性与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),下列有关说法正确的是( )
容器 | n(CO2)/mol | n(C)/mol | n(CO)/mol |
甲 | 0.1 | 0.3 | 0 |
乙 | 0 | 0 | 0.4 |









①
②
回答下列问题:


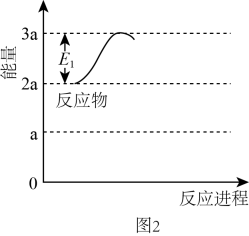
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
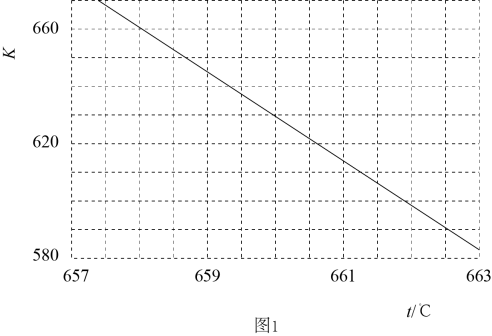
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
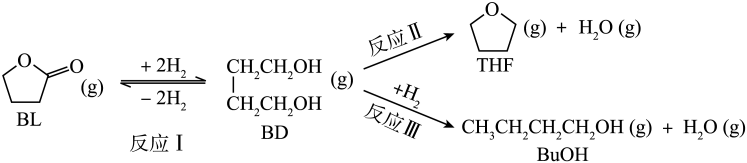
已知:①反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ、Ⅲ的影响;②因反应Ⅰ在高压氛围下进行,故
压强近似等于总压。回答下列问题:

Ⅰ.CH3CH2OH(g)CO(g)+CH4(g)+H2(g) ΔH1=+49 kJ·mol-1K1;
Ⅱ.CH3CH2OH(g)+H2O(g)2CO(g)+4H2(g) ΔH2=+256 kJ·mol-1K2;
Ⅲ.CH4(g)+H2O(g)3H2(g)+CO(g) ΔH3K3;
Ⅳ.CO(g)+H2O(g)H2(g)+CO2(g) ΔH4=-41 kJ·mol-1
①反应CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g)的ΔH=kJ·mol-1;反应III的平衡常数K3=(用K1、K2表示)。
②在0.1 MPa和650℃条件下,水醇物质的量之比与气体产率的关系如图所示。图中a、b代表的物质依次是、(填化学式)。

③在0.1 MPa、水醇比为7时,温度对气体产率的影响如图所示。在150~250℃主要发生的反应为(填“Ⅰ”或“Ⅱ”);温度高于650℃时,随着温度升高,H2的产率略有所下降,其原因是。

④在0.1 MPa,水醇比为1时,在恒压密闭容器中若只发生反应CH3CH2OH(g)+H2O(g)2CO(g)+4H2(g),达平衡时乙醇的转化率为α,则该反应的平衡常数Kp=MPa4(以平衡分压代替平衡浓度计算,分压=总压×各物质的体积分数)。
i.
ii.
iii.
①写出和
生成
的热化学方程式为。
②在压强3.0MPa, , 不同温度下
的平衡转化率和产物的选择性如图所示(选择性是指生成某物质消耗的
的物质的量占消耗
总的物质的量的百分比),

当温度超过290℃,的平衡转化率随温度升高而增大的原因是。根据图中数据计算300℃时,
的平衡产率为。

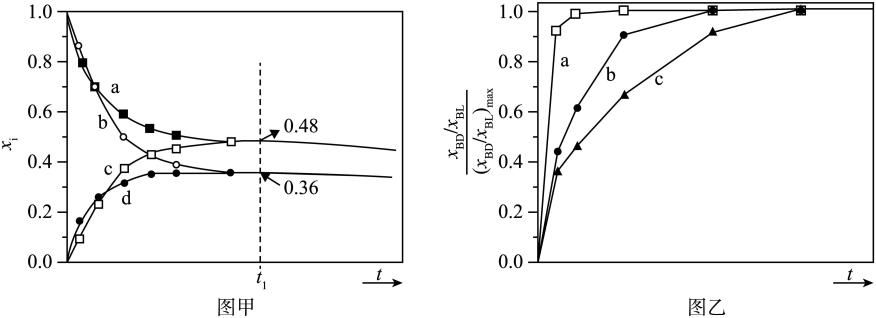
①曲线a的进料比为。
②有利于提高平衡转化率的措施是。(写出两条)。
③M点的平衡转化率为85%,
的平衡转化率为88%,则副反应的压强平衡常数
(保留2位有效数字)。(已知:分压=总压×该组分的物质的量分数)
已知: i. CO(g)+NO2(g) CO2(g)+NO(g) ΔH1= -15.9 kJ·mol-1
ii.2CO(g)+ 2NO(g) 2CO2(g)+N2(g) ΔH2= -623 kJ·mol-1
iii. 4CO(g)+ 2NO2(g) 4CO2(g)+N2(g) ΔH3
回答下列问题:

a. N2O比![]() 更容易与CO发生反应
更容易与CO发生反应
b.整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大
c.其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率

①该反应化学平衡常数的表达式K=;
②前2 min内的平均反应速率v(NO)= ;
③8 min时,若改变反应条件,导致N2的物质的量发生如图所示的变化,则改变的条件可能是。

②N2(g)+O2(g)⇌NO(g)△H2=+179kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-111.9kJ·mol-1
则2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)△H=。
第一步:快反应2NO(g)⇌N2O2(g)△H<0
第二步:慢反应N2O2(g)+O2(g)⇌2NO2(g)△H<0
活化能大小比较:Ea(第一步)Ea(第二步)(填“大于”、“等于”或“小于”)。

①V2O5/炭基材料脱硫时,通过红外光谱发现脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可表示为:SO2+V2O5+O2=VOSO4(配平方程式)、(用化学方程式表示)。
②气体流速和温度一定时,烟气中O2浓度对V2O5/炭基材料催化剂脱硫脱硝活性的影响如图2所示。当O2浓度过高时,去除率下降的可能原因是。

已知:
则 。
在 时,将CO2和CH4按物质的量之比为1∶1充入密闭容器中,分别在无催化剂及
催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:

A点CO2转化率相等的原因是。
①在恒容密闭容器中,起始压强相同,CO2的平衡转化率随反应温度、起始投料比[ ]的变化如图。则f3(填“>”、“=”或“<”,下同);B、C两点的化学平衡常数
。

②当x=3时,保持体系压强始终为 ,平衡时四种组分的物质的量分数y随温度T的变化如图所示。代表
的变化曲线是;根据图中D(390,0.12)点,列出该反应的平衡常数计算式
(以分压表示,分压=总压×物质的量分数)。

已知:2H2(g) +O2(g)=2H2O(l) ΔH=a kJ·mol-1
NaCl(aq)+H2O(l)=NaClO(aq)+ H2(g) ΔH =b kJ·mol-1
4Na2FeO4 (aq) + 10H2O(l)=4Fe(OH)3(s) +3O2 (g)十8NaOH(aq) ΔH=c kJ·mol-1
反应2Fe(OH)3(s)十3NaClO(aq) + 4NaOH(aq)=2Na2FeO4 (aq) + 3NaCl(aq) +5H2O(l)的 △H=kJ·mol-1。

①0~15s内,Cl2的平均反应速率为mol· L-1·min-1
②第一次平衡时,CO的平衡转化率为;此温度下,该反应的平衡常数KC=(保留两位有效数字)。
③在第20 s时,改变的条件是。
Ⅰ.C6H5-Cl(g)+H2S(g C6H5-SH(g)+HCl(g) ΔH1= -16.8 kJ·mol-1;
Ⅱ.C6H5- Cl(g)+ H2S(g)=C6H6(g)+HCl(g)+ S8(g) △H2= - 45.8 kJ·mol-1。
①将一定量的C6H5-Cl和H2S的混合气体充入恒容的密闭容器中,控制反应温度为T(假设只发生反应Ⅰ),下列可以作为反应Ⅰ达到平衡的判据是(填字母)。
A.气体的压强不变 B.平衡常数不变
C. v正(H2S)= v逆(HCl) D.容器内气体密度不变
②现将一定量的C6H5-Cl和H2S置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20 min测定生成物的浓度,得到图2和图3。

(R为H2S与C6H6-Cl的起始物质的量之比),图2显示温度较低时C6H5-SH浓度的增加程度大于C6H6 , 从活化能角度分析其主要原因是;结合图2和图3,该模拟工业生产制备C6H5 - SH的适宜条件为。
 (g)+4H2(g)→
(g)+4H2(g)→ ![]() (g)+2CH3OH(g) ΔH。
(g)+2CH3OH(g) ΔH。
|
化学键 |
C=O |
C−O |
C−H |
C−C |
O−H |
H−H |
|
键能/ kJ∙mol−1 |
745 |
358 |
413 |
347 |
467 |
436 |
计算上述反应的△H=;此反应自发进行的条件是(填“高温易自发”“低温易自发”或“任何温度都能自发”)。
 (g)的气体通入刚性密闭反应器中,在温度一定、压强为pMPa条件下只进行上述反应。平衡时,若压强为qMPa,平衡时
(g)的气体通入刚性密闭反应器中,在温度一定、压强为pMPa条件下只进行上述反应。平衡时,若压强为qMPa,平衡时  (g)的转化率为= (用p、q的代数式表示,下同),平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
(g)的转化率为= (用p、q的代数式表示,下同),平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。

已知,选择性= ×100%。
①由图可知,在压强为27MPa时,己二酸二甲酯制备1,6−己二醇应选择的合适温度为;选择此温度的理由是;当260℃时,转化率随着压强增大而不断增大的原因是。
②图丙为反应时间与加氢反应时反应物的转化率和选择性的关系。

综合考虑,反应时间控制在5h左右较为合适。此时1,6−己二醇的产率为。
①当分离出0.8molH2时,分离比η=。(分离比 ,实际
分离量与CH4完全转化时得到的H2量的比例,体现H2分离的程度)。
②下图是甲烷平衡转化率与温度、H2分离比的关系,其中η1、η2、η3的由大到小的关系是。

③η3=0.25时,A点气体的总压p(总)a MPa(填“>”、“=”、“<”);H2的分压p(H2)=MPa;平衡常数Kp=(MPa)2。

在提供相同的分离能量时,哪种分离方式更有利于提高甲烷平衡转化率。
I.CH4(g)+H2O(g) CO(g)+3H2(g) △H1
II.CO(g)+H2O(g) CO2(g)+H2(g) △H2<0
III.CH4(g) +2H2O(g) CO2(g)+4H2(g) △H3>0
回答下列问题:
物质 | CH4(g) | CO(g) | H2O(1) |
| -75 | -110.5 | -285.8 |
△H1=kJ·mol-1[已知:H2O(g)= H2O(1)△H= -44kJ·mol-1]。


已知:反应速率=
正-
逆=k正x(CO)·x(H2O)-k逆x(CO2)·x(H2),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。A、B、D、E四点中温度最高的是,在C点所示投料比下,当CO转化率达到40%时,
=。
①NaHCO3(s)=Na+(aq)+HCO(aq) ΔH=+18.81kJ·mol-1
②Na2CO3(s)=2Na+(aq)+CO(aq) ΔH=-16.44kJ·mol-1
③2NaHCO3(s)=Na2CO3(s)+CO2(g)+H2O(l) ΔH=+92.34kJ·mol-1
回答下列问题:
2HCO(aq)=CO
(aq)+CO2(g)+H2O(l)ΔH=kJ·mol-1。资料显示,NaHCO3固体加热到100℃发生分解,但是加热NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因。
a.HCO+H2O
H2CO3+OH- ,
b.2HCOCO
+H2O+CO2
根据理论计算0.10mol·L-1NaHCO3溶液中2个反应的转化率随温度变化如图1所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是。

T1℃时,向1L恒容密闭容器中充入0.3molCH4 , 只发生反应2CH4(g)C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),则CH4的平衡转化率为(小数点后保留一位);上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol·L-1·s-1的平均速率增多,经ts后再次达到平衡,且平衡时,c(CH4)=2c(C2H4),则t=s。
①C2H6(g) CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
②C2H4(g)+H2(g) C2H6(g) △H2=-136 kJ·mol-1
③H2(g)+CO2(g) H2O(g)+CO(g) △H3=+41 kJ·mol-1
④CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) △H4
△H4=,0.1MPa 时向密闭容器中充入CO2和C2H6 , 发生反应④,温度对催化剂K- Fe-Mn/Si 性能的影响如图:

工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是 ℃。
主反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H <0
副反应: CO2(g)+H2(g) CO(g)+H2O(g) △H>0
将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是。 实际生产中,保持压强不变,相同反应时间内不同温度下CH3OH的产率如图②所示,由图可知,523K时CH3OH的产率最大,可能的原因是。

已知: NH3·H2O的Kb=1.7 ×10-5 , H2CO3的Ka1=4.3 ×10-7 , Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20℃后用氨水吸收过量的CO2。吸收反应的化学反应方程式为,所得溶液离子浓度由大到小的顺序是(不考虑二氧化碳的溶解)。