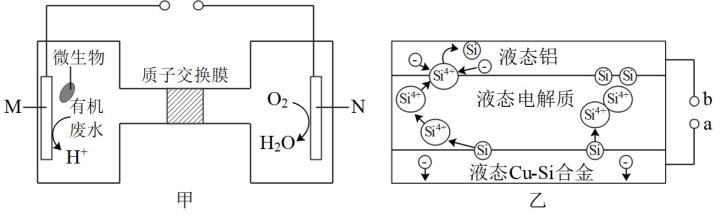



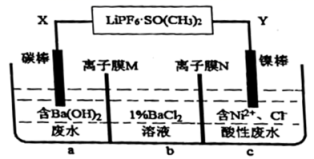
下列说法正确的是( )
 D . 电解饱和食盐水的反应:2Cl-+2H+
D . 电解饱和食盐水的反应:2Cl-+2H+ 
| 金属离子 | ||||
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
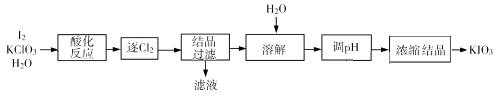
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是。“滤液”中的溶质主要是。“调pH”中发生反应的化学方程式为。
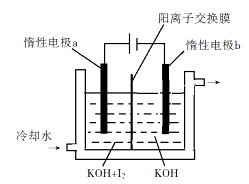
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为,其迁移方向是。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有(写出一点)。
H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=0(填“>”或“=”)
a.容器内气体压强保持不变
b.吸收ymol H2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.
①电解一段时间后,c(OH﹣)降低的区域在(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为.
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因.
①若将一定量的CO2和H2投入1.0L恒容密闭容器中合成甲醇,实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。则该反应的正反应为(填“放热”或“吸热”)反应,在p2及512K时,图中N点处平衡向(填“正向”或“逆向”)移动;

②若将物质的量之比为1:3的CO2和H2充入体积为1.0L的恒容密闭容器中反应,不同压强下CO2转化率随温度的变化关系如下图所示。

a.A、B两条曲线的压强分别为、
, 则
(填“>”“<”或“=”);
b.若A曲线条件下,起始充入CO2和H2的物质的量分别为1mol、3mol,且a点时的K=300(L2/mol2),则a点对应CO2转化率为。
第一步:[M]+H2O(g)=[M]O+H2(g)
第二步:[M]O+CO(g)=[M]+CO2(g)
①第二步比第一步反应慢,则第二步反应的活化能比第一步(填“大”或“小”)。反应过程中,中间产物[M]O的能量比产物的能量(填“高”或“低”);
②研究表明,此反应的速率方程为 , 式中)
、
分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,该反应的Kp(填“增大”或“减小”)。根据速率方程分析,T>Tm时v逐渐减小的原因是。


(a)CH4(g)C(s)+2H2(g) ΔH1=akJ·mol-1
(b)CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=bkJ·mol-1
(c)2CO(g)CO2(g)+C(s) ΔH3=ckJ·mol-1
(d)······
根据盖斯定律,反应CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH = kJ·mol-1。
原电池法:我国科学家研究Li—CO2电池,取得重大突破。该电池发生的原电池反应为:4Li+3CO2=2Li2CO3+C。
①在Li—CO2电池中,Li为单质锂片,是该原电池的(填“正”或“负”)极。
②CO2电还原过程依次按以下四个步骤进行,写出步骤I的电极反应式
i.
ii.C2O=CO
+CO2
iii.CO2+2CO=2CO
+C
iv.CO+2Li+=Li2CO3

①Pt片为电解池的极。
②写出CO2还原为HCOO-的电极反应式:。
③电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是。
|
电压/V |
实验现象 |
|
2.0 |
阳极缓慢产生少量气泡,阴极没有气泡 |
|
3.0 |
阳极产生较多气泡,阴极产生少量气泡 |
|
>5.0 |
两极均快速产生大量气泡,阴极产生气泡的速率约为阳极的2倍 |
阳极产生的气体是。
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
电极材料 |
阴极:石墨 阳极:石墨 |
阴极:石墨 阳极:石墨 |
阴极:石墨 阳极:铁 |
|
加入的物质 |
1 mL浓硫酸 |
1 mL浓硫酸、 少量硫酸铁 |
1 mL浓硫酸 |
|
电极表面是否产生气泡 |
两极均产生气泡 |
两极均产生气泡 |
阴极:产生气泡 阳极:无明显气泡产生 |
|
Cr2O72−还原率/% |
12.7 |
20.8 |
57.3 |
|
阴极变化 |
实验结束后取出电极,仅Ⅰ中阴极上附着银白色固体,经检验为金属Cr |
||
对比Ⅰ、Ⅱ可知,阴极表面是否析出金属Cr,以及Ⅱ中Cr2O72−的还原率提高均与填离子符号)有关。
①阳极区:阳极反应:,进而使Cr2O72−被还原。
②阴极区:由于,进而促进了Cr2O72−在阴极区被还原,依据的实验现象是。
①“ 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4 , MnO2和(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为,阴极逸出的气体是。
③“电解法”和“ 歧化法”中,K2MnO4的理论利用率之比为。
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。

已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
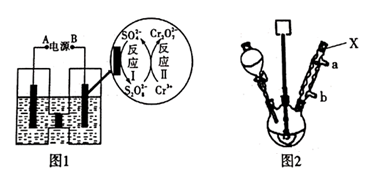
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4 , 析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是,冷却水应从口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用法完成。
⑤该合成技术的优点是实现了(填化学式)的循环利用,绿色环保。
|
第一次 |
第二次 |
第三次 |
第四次 |
|
|
体积( mL) |
23.00 |
23.10 |
21.40 |
22.90 |


已知某些硫化物的性质如下表:
物质 | 性质 |
Fe2S3 Al2S3 | 在水溶液中不存在 |
FeS | 黑色,难溶于水,可溶于盐酸 |
CuS | 黑色,难溶于水,难溶于盐酸 |
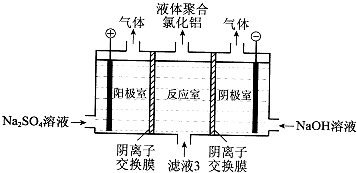
①写出阴极室的电极反应:.
②简述在反应室中生成聚合氯他铝的原理:.
a.离子反应 b.化合反应 c.中和反应 d.氧化还原反应
H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol﹣1 (a)
2SO3(g)⇌2SO2(g)+O2(g)△H=+196kJ•mol﹣1 (b)
H2O(l)═H2O(g)△H=+44kJ•mol﹣1 (c)
H2SO4(l)分解为SO2(g)、O2(g)及H2O(l)的热化学方程式为:.
提高H2SO4(l)的分解率的方法是(写两种).
①Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);随温度的升高,M曲线逼近L曲线的原因是:
②若X点时总压为0.1MPa,列式计算SO3分解反应在图中X点的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字).
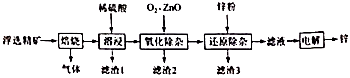
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+ , 需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果.

已知:TiOSO4遇水会水解.
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异

①写出阳极所发生反应的电极反应式:.
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释).


图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为.
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应.
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因.
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mg•L﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mg•L﹣1min﹣1(结果保留两位有效数字).
②C(s)+2H2O(g)⇌CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
△H3=kJ/mol,在反应①的体系中加入催化剂,△H1(填“增大”“减小”或“不变”).
①图1中N表示的是(填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=mol/(L•min).
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强.X表示的物理量是(填“温度”或“压强”),L1 (填“>”或“<”) L2 .

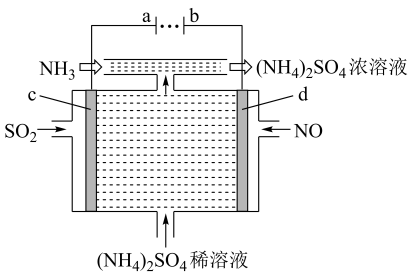
①写出电解时NO2发生反应的电极反应式:.
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 mol.
①实验前,配制10L0.2mol•L﹣1硝酸溶液需量取 mL的密度为1.4g•mL﹣1、质量分数为63%的浓硝酸.
①不锈钢作极,写出该电极的电极反应式.
②分析阳极区能得到重铬酸钾溶液的原因.
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为
①Na2S2O5参加反应的离子方程式为.
②经上述工艺处理后的废水,理论上Cr3+浓度约为 mg•L﹣1 .
(已知室温下Ksp[Cr(OH)3]≈6×10﹣31)
![]()
①阴极室的电极反应式是.
②电解过程阳极室溶液pH的变化是(填“增大”、“减小”或“不变”).
③简述在反应室中生成液体聚合硫酸铝铁的原理.


①反应的平衡常数表达式为;
②反应开始到平衡时H2的消耗速率v(H2)=;
③能判断该反应是否达到化学平衡状态的依据是;
a 容器中压强不变 b.混合气体的密度不变
c.3v(H2)=2v(NH3) d.c(N2):c(H2):c(NH3)=1:3:2
④对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是;
a 选用更高效的催化剂 b 升高温度c 及时分离出氨气 d 增加H2的浓度
⑤如今采用SCY陶瓷固体电解质的电化学合成氨装置(如图2),该装置用可以传导质子的固态物质作为介质.电池总反应为N2(g)+3H2(g)⇌2NH3(g),那么该电解池阴极反应式为,当阳极失去0.6mol电子时,阴极产生的气体在标准状态下的体积为.
Ⅰ.SO2+2H2O+I2=H2SO4+2HIⅡ.2H2SO4=2SO2+O2+2H2OⅢ.2HI=H2+I2
在反应器中加入SO2、I2、H2O的物质的量分别为1mol、9mol、16mol,充分反应静置后得到混合物分成两层﹣﹣上层是含低浓度I2的H2SO4层和下层是高浓度的I2的HI层.
①根据上述事实,下列说法正确的是(选填序号).
a.H2SO4溶液和HI溶液不互溶
b.HI溶液的密度大于H2SO4溶液的密度
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是.
③HI层中存在I﹣+I2⇌I3﹣ , c(H+) c(I﹣)+c(I3﹣)(填大于、小于或等于)
2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol
则2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)的△H=kJ/mol
①通电电解前需要向阴极区通入氩气,其目的是
②写出阳极电极反应式.
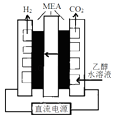
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:,残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 | Au+6HNO3⇌Au(NO3)3+3NO2↑+3H2O | <<1 |
2 | Au3++4Cl﹣⇌AuCl4- | >>1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因.
②滤液含量的测定:以下是该小组探究滤液的一个实验流程.

则100mL滤液中Cu2+的浓度为 mol•L﹣1 , Fe2+的浓度为 mol•L﹣1 .
方法1:还原沉淀法
该法的工艺流程为④③②①
CrO
Cr2O72﹣
Cr3+
Cr(OH)3↓
其中第①步存在平衡:2CrO42(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O
a.Cr2O 和CrO42的浓度相同
b.2v(Cr2O )=v(CrO42)
c.溶液的颜色不变
Cr(OH)3(s)⇌Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5 mol/L,溶液的pH应调至.
方法2:电解法
该法用Fe做电极电解含 Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.