
已知:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) △H=-2043.9kJ/mol
C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(g) △H=-1926.1kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ/mol
下列说法错误的是( )

| 选项 | 应用 | 解释(离子方程式) |
| A | 淀粉—KI溶液(稀硫酸酸化)检验碘盐中含KIO3 | |
| B | 电解饱和食盐水制氢气和氯气 | |
| C | 醋酸用于除去水垢 | |
| D | 氯化铁用于蚀刻铜板 | |


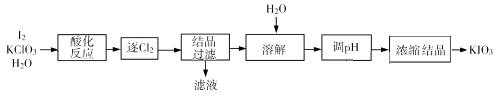
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是。“滤液”中的溶质主要是。“调pH”中发生反应的化学方程式为。
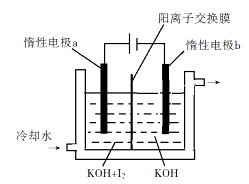
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为,其迁移方向是。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有(写出一点)。

其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
P/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3kJ·mol-1
则反应N2O5(g)=2NO2(g)+ O2(g)的△H= kJ·mol-1
②研究表明,N2O5(g)分解的反应速率v=2×10-3× (KPa·min-1),t=62min时,测得体系中
=2.9kPa,则此时的
= kPa,V= kPa,min-1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强pX(35℃)63.1kPa(填“大于”“等于”或“小于”),原因是。
④25℃时N2O4(g) ⇋2NO2(g)反应的平衡常数Kp= kPa (Kp为以分压表示的平衡常数,计算结果保留1位小数)。
第一步N2O5⇋NO3+NO2 快速平衡
第二步NO2+NO3⇀NO+NO2+O2 慢反应
第三步NO+NO3⇀2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。

已知:
Ⅰ.三氟化硼易与水反应;三氯化硼
易潮解;三氯化铝
)沸点低、易升华。
Ⅱ.部分物质的沸点如表所示:
物质 | |||
沸点/℃ | -101 | 12.5 | 180 |
Ⅲ.
回答下列问题:
①到达滴定终点的现象为。
②计算的产率为%(保留一位小数)。

若AB电源是甲醇在酸性环境的燃料电池,则甲中C极的电极反应式为。

浓硝酸一般盛放在棕色试剂瓶中,原因是。

①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
①检验ZnS固体是否洗涤干净的方法是;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为;
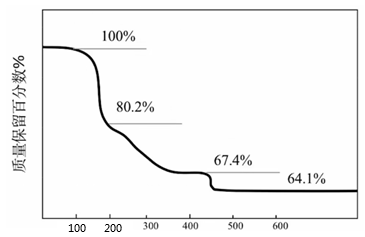
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化的曲线如图,从滤液中得到Na2SO4·10H2O的操作方法是。


①乙烯使溴的四氯化碳溶液褪色和乙烯使酸性KMnO4溶液褪色
②苯与液溴在催化剂作用下的反应和乙醇使酸性KMnO4溶液褪色
③甲烷光照条件下与氯气反应和苯与硝酸在浓硫酸条件下反应
第一步:反应CH2=CH2+HOSO3H(浓硫酸)→CH3CH2OSO3H (硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
①第一步属于(填反应类型)反应;
②上述整个过程中浓硫酸的作用是(填选项)
A.氧化剂 B.催化剂 C.还原剂

已知:①图中所列各步变化均已完全反应;②气体乙中含有2种单质气体。
①化合物甲与NaOH溶液反应的化学方程式为。
②若检验所得溶液显碱性,常用到的试剂是;若反应所得溶液中还存在另一种阴离子,则检验该阴离子常用的试剂是。

经认真分析,确定猜想___________不成立(填序号);
 ①仪器B的名称为;
①仪器B的名称为;
②加热前先通一段时间N2 , 加热至完全分解后再通入过量N2 , 实验过程中观察到装置D始终无明显现象,装置C和E均产生白色沉淀。
ⅰ.下列判断错误的是
A.C中的沉淀一定有BaSO4
B.C中的沉淀不可能含有BaSO3
C.加热至完全分解后再通入过量N2的目的是将分解产生的气体全部排到B、C装置中使其全部被吸收
D.D中无明显现象是因为SO2不能与BaCl2反应
ⅱ.写出E中所发生反应的化学方程式;
第一步:该红色固体用溶解(填“盐酸”或“稀硫酸”);
第二步:为了检验是否存在Fe2+ , 向所得溶液中滴加试剂,观察是否褪色。
可用O3氧化法处理氮氧化物,已知:
①2NO(g)+O2(g)=2NO2(g) ΔH1=-113kJ/mol
②4NO2(g)+O2(g)=2N2O5(g) ΔH2=-57kJ/mol
③6NO2(g)+O3(g)=3N2O5(g) ΔH2=-227kJ/mol
用O3氧化脱除NO的总反应是:NO(g)+O3(g)=NO2(g)+O2(g) ΔH4=。

由CO2转化为羧酸是CO2资源化利用的重要方法。在催化作用下CO2和CH4合成CH3COOH的化学方程式为;在合成CH3COOH的反应中,下列有关说法正确的是(填字母序号)。
A.利用催化剂可以提高反应物的转化率
B.有22.4LCH4(标况)参与反应时转移4mol电子
C.CH4→CH3COOH过程中,所有的化学键都发生断裂
D.该反应为放热反应

①已知该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-130.9kJ/mol,此反应的活化能E(a)正E(a)逆(填“>”或“<”)。
②下列措施不能使CO2的平衡转化率提高的是(填字母序号)。
A.改用更高效的催化剂
B.增大H2与CO2的投料比
C.升高温度D.增大压强
③200℃时,将2molCO2和4molH2充入2L密闭容器中,在催化作用下反应达到平衡。若平衡时CO2的转化率为50%,则此温度下该反应的平衡常数K=(已知CH3OH的沸点为64.7℃)。



①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是.
②碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:.