实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
 下列说法错误的是( )
下列说法错误的是( )
SCR(选择性催化还原)工作原理:
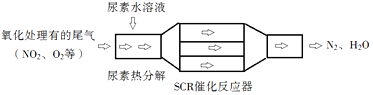
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式:.
②反应器中NH3还原NO2的化学方程式:.
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒.用化学方程式表示(NH4)2SO4的形成:.
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 mol•L﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是.
NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.
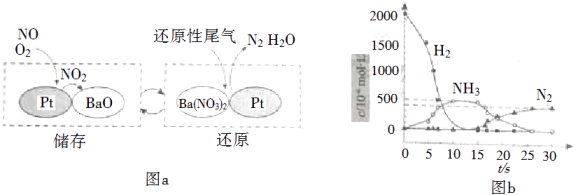
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原.储存NOx的物质是.
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是.
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整:.
沸点:苯80.1℃、石油醚30~80℃、苯乙酮202℃。
密度:苯0.88 g/mL
乙酸酐1.07 g/mL
原理:C6H6+(CH3CO)2O C6H5COCH3+CH3COOH
实验步骤:
步骤1:在50 mL的二口瓶上,按照如图所示安装恒压滴液漏斗、回流冷凝管和装有无水氯化钙的干燥管等。

在二口瓶中加入6 g无水氯化铝和8 mL纯净苯,边用磁力搅拌器搅拌边滴加2 mL乙酸酐。严格控制滴加速率,必要时用冷水冷却,待反应缓和后,加热回流并搅拌,直至无HCl气体逸出为止。
步骤2:待反应液冷却后,将其倾入盛有10 mL浓盐酸和20 g碎冰的烧杯中,使胶状物完全溶解。然后将反应液倒入分液漏斗分出上层有机相,再用20 mL石油醚进行两次萃取,萃取后合并有机相。依次用5mL10%NaOH和5mL水洗至中性,再用无水硫酸镁干燥。
步骤3:滤去干燥剂,将有机相置于100mL蒸馏烧瓶中,用加热套加热,使用不同的冷凝管进行蒸馏,先蒸出石油醚和苯,再蒸出苯乙酮。该实验得到的产品为1.64 g。
回答下列问题:

已知:HgCl2·HgO是难溶于CCl4的固体。回答下列问题:
①冰水浴冷却的目的是。
②过滤后滤液的主要成分有。
|
序号 |
0.1mol/LNaClO溶液/mL |
0.1mol/LNaCl溶液/mL |
0.1moL/LNaOH溶液/mL |
H2O/mL |
品红溶液 |
现象 |
|
Ⅰ |
5. |
0 |
0 |
5.0 |
3滴 |
较快褪色 |
|
Ⅱ |
0 |
5.0 |
A |
0 |
3滴 |
不褪色 |
|
Ⅲ |
5.0 |
0 |
5.0 |
0 |
3滴 |
较慢褪色 |
①a=。
②由上述实验得出的结论是。
CH3COOH+H2O2 CH3COOOH+H2O △H<0

①写出H2O2的电子式。
②装置中油水分离器的作用是将水从体系中分离出来,有利于反应向(填“正向”或“逆向”)进行,也可以通过观察油水界面不再增高时,判断反应结束。
③反应体系采用减压的目的是降低共沸物的沸点,防止。
![]()
①过氧乙酸被Fe2+还原,产物之一为CH3COOH,其离子方程式为。
②若样品体积为V0mL,加入c1mol•L-1FeSO4溶液V1mL,消耗c2mo•L-1K2Cr2O7 , 溶液V2mL,则过氧乙酸含量为 g·L-1。
③若用KMnO4溶液除H2O2时,不慎滴加KMnO4过量,则导致最终测定过氧乙酸的含量 (填“偏高”、“偏低”或“不变”)。

已知:
①制备原理:C2H5OH+4Cl2→CCl3CHO+5HCl。
②CCl3CHO易被HClO氧化生成CCl3COOH。

| 第一次 | 第二次 | 第三次 | |
| 滴定前读数/mL | 0.00 | 0.12 | 0.20 |
| 滴定后读数/mL | 19.98 | 21.52 | 20.22 |
①指示剂为。
②产品的纯度为(写表达式)。



已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
|
环境 |
调节溶液氧化环境时的现象 |
加热煮沸3min期间产生的现象 |
|
中性 |
加入VmL蒸馏水,无明显现象 |
30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
|
碱性 |
加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) |
10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
|
酸性 |
加入VmL稀H2SO4无明显现象 |
煮沸3min后,有气泡冒出 |
①在(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为 g(用含V1的代数式表示,5H2O2~2 )。

|
实验步骤 |
预期现象 |
结论 |
|
|
|
固本残留物仅为Fe2O3 |
Ⅰ.常温常压下,Cl2O 为棕黄色气体,沸点为 3.8℃,42 ℃以上会分解生成 Cl2 和 O2 , Cl2O 易溶于水并与水立即反应生成 HClO。
Ⅱ.将氯气和空气(不参与反应)按体积比1∶3 混合通入潮湿的碳酸钠中生成Cl2O 气体,用水吸收Cl2O(不含 Cl2)制得次氯酸溶液。某实验室利用以下装置制备浓度不小于 0.8mol/L 的次氯酸溶液。
A.  B.
B.  C.
C.  D.
D.  E.
E. 
回答下列问题:
已知:NaNH2极易水解且易被空气氧化。回答下列问题 :


用注射器向试管中缓慢加入H2O至恰好完全反应立即停止,G中液面从刻度V1变 为 V2(已知V2>Vi,单位 mL,忽略固体体积,读取刻度时保持两使液面相平,实验过程处于标准状况下),则产品纯度为:若读取V1时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度(填“偏高”、“ 偏低”或“无影响”)。
[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)

实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
检验装置D内溶液中有SO32- , 无SO42-的实验操作和现象是;


①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是。
②若缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1 , 则缓蚀效果最好时钼酸钠(M =206g·mol-1) 的物质的量浓度为(计算结果保留3位有效数字)。

试剂相关性质如下表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:

。

①A 点时剩余固体的成分是(填化学式)。B 点时剩余固体的成分是(填化学式)
②从开始加热到 750K时总反应方程式为。
①电解过程中 NaCl 的作用是。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1 , 则溶液中c(Cr3+)为mol·L-1。

回答下列问题:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-=2Cl-+5I2+4H2O;2S2O32-+I2=2I-+S4O62-)
①配制100mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和。
②原溶液中ClO2的含量为(用含c、V1、V2的代数式表示)g·L-1。

①装置A中发生反应的化学方程式为。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是。
③装置B中盛放的试剂是,装置D的作用是。
④有同学认为该装置有一个缺陷,该缺陷是。


(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量(填“偏大”“ 偏小” 或“无影响”)。
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=。

①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
①检验ZnS固体是否洗涤干净的方法是;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为;
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图,从滤液中得到Na2SO4·10H2O的操作方法是。

步骤Ⅰ:取铝黄铜合金加入热浓硫酸溶解,再加入过量NaOH溶液只生成Cu(OH)2沉淀,过滤,洗涤。
步骤Ⅱ:向Cu(OH)2沉淀中加硫酸溶解,再加氨水,形成 [Cu(NH3)4]SO4溶液。
步骤Ⅲ:向[Cu(NH3)4]SO4溶液中通入SO2气体至溶液呈微酸性,生成NH4CuSO3。再与足量的1.000mol·L-1的稀硫酸混合并微热,得到超细铜粉。