|
|
|
|
|
|
① | ② | ③ | ④ | ⑤ | ⑥ |
 B .
B .  C .
C .  D .
D . 

已知:①2-呋喃甲酸乙酯为无色液体,相对于水的密度为1.117,沸点为196℃;
②2-呋喃甲酸的沸点为230℃,乙醇的沸点为78.4℃;③苯与水可形成共沸物,共沸点为69.25℃。
下列说法错误的是( )

 加热熔融的氢氧化钠固体
B .
加热熔融的氢氧化钠固体
B .  吸收CO2中的HCl杂质
C .
吸收CO2中的HCl杂质
C .  吸收尾气中的Cl2
吸收尾气中的Cl2


选项 | 玻璃仪器 | 实验目的 |
A | 棕色酸式滴定管、胶头滴管 | 用cmol·L-1AgNO3溶液滴定待测液中的Cl- |
B | 烧杯、漏斗、玻璃棒 | 提纯乙酸乙酯(含少量乙酸和乙醇) |
C | 表面皿、玻璃棒 | 鉴别Na2CO3溶液和NaHSO4溶液 |
D | 量筒、烧杯、250mL容量瓶、胶头滴管 | 由浓盐酸配制250mL1.0mol·L-1盐酸 |
 C .
C .  D .
D . 
选项 | A | B | C | D |
实验 | 2NO2(g)(红棕色)
|
有白色沉淀产生 |
均有白色沉淀 |
产生白色沉淀(AgSCN) |
结论 | 正反应放热 | 白色沉淀一定 是BaSO3 | 待测液中含有Cl-和SO | Ag+与Fe2+不反应 |
选项 | 实验目的 | 玻璃仪器 | 试剂 |
A | 海带提碘中反萃取获得碘 | 烧杯、玻璃棒、分液漏斗 | 浓NaOH溶液、45%硫酸溶液 |
B | 滴定法测定 | 酸式滴定管、烧杯、胶头滴管 |
|
C | 比较Mg、Al金属性的强弱 | 试管、胶头滴管 |
|
D | 比较 | 试管、胶头滴管 |
|
A | B | C | D |
|
|
|
|
制取氯气 | 验证SO2的漂白性 | 收集NO2并防止其污染环境 | 量取一定体积KMnO4标准溶液 |
选项 | A | B | C | D |
实验 | 准确量取一定体积的 | 高温熔融烧碱 | 用图示的方法检查此装置的气密性 | 蒸发 |
装置 |
|
|
|
|
A | B | C | D |
|
|
|
|
干燥SO2 | 实验室制取氨气 | 吸收NH3 | 探究CH4与Cl2的反应 |
① ,合适反应温度为
;副反应:
。
②常压下, 沸点
,熔点
;
沸点2.0℃,熔点
。
③ ,
在
中的溶解度远大于其在水中的溶解度。
请回答:

②将上图中装置组装完整,虚框D中应选用。

针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→→→e→d→f→。
a.检查旋塞、玻璃塞处是否漏水
b.将溶液和 转入分液漏斗
c.涂凡士林
d.旋开旋塞放气
e.倒转分液漏斗,小心振摇
f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体
h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
实验数据如下表:
| 加入量 | |
| 滴定Ⅰ测出量 | |
| 滴定Ⅱ测出量 | |
①用标准 溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是。
②高纯度 浓溶液中要求
(
和
均以
计)。结合数据分析所制备的
浓溶液是否符合要求。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
步骤I. 的制备
 步骤Ⅱ.产品中
步骤Ⅱ.产品中 含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
;
④平行测定三次, 平均值为22.45,
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
| 温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| | 11.9 | 15.8 | 21.0 | 27.0 | |||
| | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
回答下列问题:
 C .
C .  D .
D . 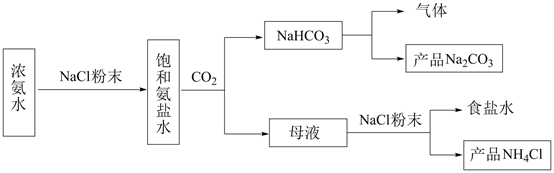
回答下列问题:
A. 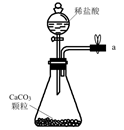 B.
B. 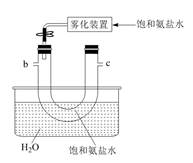 C.
C.  D.
D. 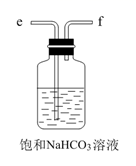 E.
E. 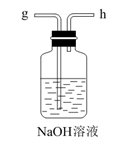
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。

I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
IV.离心分离,稀盐酸洗涤沉淀。
V.蒸馏水洗涤沉淀。
VI.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
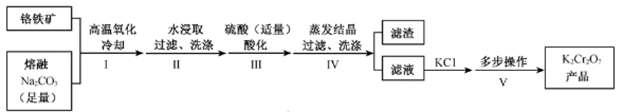
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
Cr2O
+H2O
相关物质的溶解度随温度变化如下图。
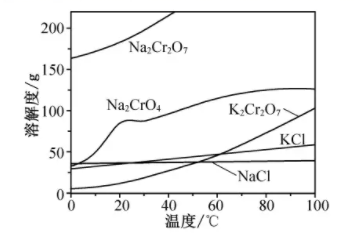
请回答:
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
①下列关于滴定分析的操作,错误的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)

Ⅰ、测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH−=2MnO(OH)2↓
酸性条件下,MnO(OH)2将I−氧化为I2:②MnO(OH)2+I−+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32−+I2=S4O62−+2I−
Ⅱ、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
①滴定管②注射器③量筒

主要反应有:
碱溶: (CNO)3H3+2NaOH=(CNO)3Na2H+2H2O △H <0
氯化: (CNO)3Na2H+2Cl2 (CNO)3Cl2H+2NaCl △H <0
图中仪器a的名称为。
将B装置中制得的(CNO)3Cl2H与NaOH溶液按物质的量比1:1进行中和,写出中和反应的化学方程式, 反应完成后冷却结晶、过滤、干燥得到(CNO)3Cl2Na。
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2=
+2I-
实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是。
②该样品中有效氯含量的表达式为
(有效氯=)。
①实验室制备的离子方程式是。
②选用如图所示的部分装置,欲用二氧化锰制备一瓶纯净且干燥的氯气,各玻璃导管接口连接顺序为(气流方向从左至右,每组仪器最多使用一次)。

③实验中“先通入 , 待反应装置中充满黄绿色气体时,再将
缓缓通入”,此操作的目的是。

①仪器X为恒压滴液漏斗,用它代替分液漏斗优点是。
②若无干燥装置,会与水反应产生无色气体和白雾,且该气体在试管口变为红棕色,则发生反应的化学方程式为。
①滴定时,应使用(填“酸式”或“碱式”)滴定管。
②滴定达到终点的标志是。
③亚硝酰氯()的质量分数为(用计算式表示即可)。
a.减压加热浓缩 b.高压加热浓缩 c.常压高温浓缩 d.常压常温浓缩
该制备方法中,溶液内生成的反应包括2个,化学方程式分别是
、。
①所选取的滴定管种类及滴定管中溶液调节的位置合理的是(填字母),滴定终点的现象是。
a.酸式滴定管 0刻度 b.碱式滴定管 0刻度
c.酸式滴定管 0刻度以下某准确刻度 d.碱式滴定管 0刻度以下某准确刻度
②在配制的样品溶液中加入还原剂,将还原为
, 直至反应完全,过滤、洗涤。将滤液、洗涤液均转移到锥形瓶中,加稀硫酸,再用a
溶液进行滴定,至终点时消耗VmL
标准溶液,该三草酸合铁酸钾样品中铁元素的质量分数的表达式为%。
氧钒(IV)碱式碳酸铵晶体的化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,难溶于水,是制备热敏材料VO2的原料。实验室以V2O5为原料合成该晶体的流程如图。

已知:+4价钒在弱酸性条件下具有还原性。

①仪器b的名称是,盛装的试剂是。
②实验时,先关闭K2 , 打开K1 , 当观察到D中出现白色浑浊时,再关闭K1 , 打开K2 , 这样操作的目的是。
③反应结束后,得到紫红色晶体,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次。检验用饱和NH4HCO3溶液洗涤沉淀是否干净的操作是。
①粗产品中钒的质量分数为%(用含有a、b的式子表示)。
②若实验测得钒的质量分数偏大,则可能的原因是。
A.(NH4)Fe(SO4)标准溶液被氧化
B.滴定前平视读数,滴定终点时仰视读数
C.滴定前,滴定管内无气泡,滴定结束后尖嘴有气泡

某化学兴趣小组在实验室中根据上述流程进行模拟实验。流程中①中的反应实验装置图(待完善)如下。 
请回答:
①实验过程中,移液管洗涤干净并用蒸馏水清洗2~3次后,进行的后续一系列操作如下。
a.吸取少量待取液润洗2~3次
b.将润洗好的移液管插入待取溶液底部,吸取溶液使液面至标线以上
c.松动食指使液面缓慢下降至溶液的凹液面与标线相切,立即按紧管口
d.用吸水纸吸净尖端内、外的残留水
e.将润洗好的移液管插入待取溶液液面下约1-2cm处,吸取溶液使液面至标线以上
f.将移液管提出液面,倾斜容器,将管尖紧贴容器内壁成约45°角,稍待片刻
g.拿掉洗耳球,立即用食指堵住管口,使液体不再流出
h.当溶液流尽后,再停数秒,并将移液管向左右转动一下,取出移液管
i.将移液管垂直放入稍倾斜的锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出
请选择正确操作的编号,按顺序排列:→→→g→f→→→(序号不重复)
②为使实验结果更加精确,滴定过程中最好选用下列指示剂中的哪一种。
A.甲基橙 B.石蕊 C.酚酞

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2 , 生成NaClO2 , 使用时加酸只释放出ClO2一种气体;②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;③有关物质沸点如表:
物质 | CH3OH | HCOOH | ClO2 |
沸点 | 64.7℃ | 100.8℃ | 11℃ |
请回答:
相关物质性质:
物质名称 | 相对分子质量 | 颜色、状态 | 溶解性 | 沸点/℃ | 毒性 |
苯乙腈 | 117 | 无色油状液体,密度比水大 | 难溶于水,溶于醇 | 233.5 | 有毒 |
氯化苄 | 126.5 | 无色或微黄色的透明液体 | 微溶于水,混溶于乙醇 | 179.4 | 有毒 |
氰化钠 | 49 | 白色结晶颗粒或粉末 | 易溶于水 | 1496 | 剧毒 |
二甲胺 | 45 | 无色气体,高浓度有类似氨的气味 | 易溶于水,溶于乙醇 | 6.9 | 有毒 |
反应原理:![]() (氯化苄)+NaCN
(氯化苄)+NaCN![]() (苯乙腈)+NaCl
(苯乙腈)+NaCl
主要装置:
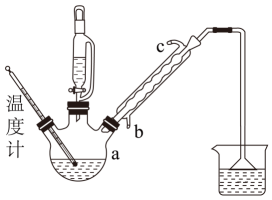
实验步骤:
①向仪器a中加入氯化苄25.3g,缓慢加入适量二甲胺水溶液,放入磁子搅拌。
②安装好球形冷凝管、恒压漏斗及温度计,开启冷凝水,并对仪器a进行加热至90℃。
③向恒压漏斗中加入30%氰化钠水溶液49.0g。
④控制滴加速度与反应温度,使反应在90±5℃下进行。
⑤滴加结束后,加热回流20小时。
⑥反应结束并冷却至室温后,向混合物中加100mL水,洗涤,分液。
⑦往得到的粗产物中加入无水CaCl2颗粒,静置片刻,倒入蒸馏烧瓶中,弃去CaCl2 , 进行减压(2700Pa)蒸馏,收集115~125℃馏分,得到产品无色透明液体22.3g。
回答下列问题:

已知:①含锌铜烟尘经过预处理后的主要成分是ZnO,还含有少量的CuO和Fe2O3
②25℃时溶液中金属离子物质的量浓度c与pH的关系如图所示:

当溶液中某离子浓度c≦1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
A.氢氧化钠B.氨水C.氧化锌D.氢氧化钙
A.坩埚B.表面血C.蒸发皿D.烧杯E.试管F.泥三角G.坩埚钳H.干燥器
②测定产品中肼的质量分数。称取m g装置B中溶液,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定过程中指示剂可选用,滴定终点平均消耗标准溶液V mL,产品中肼质量分数的表达式为。