已知:①镓(Ga)和铝同主族,具有相似的化学性质。
②25℃时,。

 B .
B .  C .
C .  D .
D . 



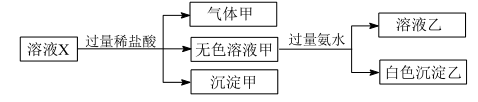
下列判断正确的是( )


已知:i.二价金属氧化物能分别与氨配合生成配离子,如[Fe(NH3)2]2+、[Mn(NH3)2]2+、[Zn(NH3)4]2+;
ii.25℃时相关物质的Ksp如下表:
物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
Ksp | 2.5×10-13 | 6.3×10-18 | 1.6×10-24 | 8.0×10-28 | 3.6×10-29 | 5.0×10-36 |
iii.Zn(OH)2和ZnCO3的分解温度分别为125℃、300℃。
请回答下列问题:

①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为(填字母)。
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是(写出一种)。
③混合气体e可返回至“”阶段循环利用。

已知:钨精矿分解渣的主要化学成分及含量
名称 | MnO2 | Fe2O3 | CaO | SiO2 | WO3 | ZnO | 其它 |
含量 | 34.8% | 26.1% | 7.6% | 8.8% | 0.75% | 0.66% | - |
①WO3不溶于水、不与除氢氟酸外的无机酸反应。
②Ksp(ZnS)=3×10-25、Ksp(MnS)=2.4×10-13

已知:①lg3≈0.5
②常温下,部分金属化合物的Ksp近似值如表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 1.0×10-17 | 2.7×10-39 | 1.3×10-33 | 1.0×10-15 |
回答下列问题:
a.氨水 b.N aOH c.NiO d.NaClO
温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
晶体形态 | NiSO4•7H2O | NiSO4•6H2O | 多种结晶水合物 | NiSO4 |
从“滤液3”获得稳定的NiSO4•6H2O晶体的操作是。
①SDD可表示为![]() ,中性螯合物沉淀的结构式为。
,中性螯合物沉淀的结构式为。
②若使用Na2S做沉淀剂,除了因体系pH过低会产生H2S外,还会产生絮状无定型沉淀,造成。

②代表电池(填“充电”或“放电”)过程,该过程的电极反应式为。

已知:①镓又称为“类铝”,其性质与铝类似;
②一些金属离子开始沉淀和沉淀完全的pH及萃取率如下表所示:
金属离子 | Fe3+ | Ga3+ | Zn2+ | Fe2+ |
开始沉淀 | 1.7 | 3.0 | 5.5 | 8.0 |
沉淀完全 | 3.2 | 4.9 | 8.0 | 9.6 |
萃取率(%) | 99 | 97 ~98. 5 | 0 | 0 |
回答下列问题:


“操作1”需选择“高压浸出”的理由是;
a.其原理属于热还原法冶金
b. 的金属活动性可能位于
、
之间
c.工业上可用与钼酸盐溶液直接作用冶炼钼

回答下列问题:
①写出BH的结构式是(标明其中的配位键)。
②常温下,TiCl4是一种有刺激性臭味的无色液体,熔点为-23.2℃,沸点为136.2℃;TiF4为白色粉末,熔点为377℃。TiCl4和TiF4熔点不同的原因是。


废铁屑表面往往含有油污,去除废铁屑表面的油污的方法是。操作①要用到的玻璃仪器有玻璃棒、烧杯和。

判断沉淀完全的操作为。

已知:
①在空气中易被氧化,易与
形成复盐沉淀;
②硫脲(![]() )具有还原性,酸性条件下易被氧化为
)具有还原性,酸性条件下易被氧化为;
③在硫酸体系中能被萃取剂[
]萃取,而
不能。
回答下列问题:


已知:
①钯常见的化合价有+2和+4价。钯容易形成配位化合物,如[Pd(NH3)4]Cl2、[Pd(NH3)2]Cl2、[H2Pd(NO3)4]。
②当有硝酸存在时,钯易与硝酸形成稳定的配位化合物。
回答下列问题:
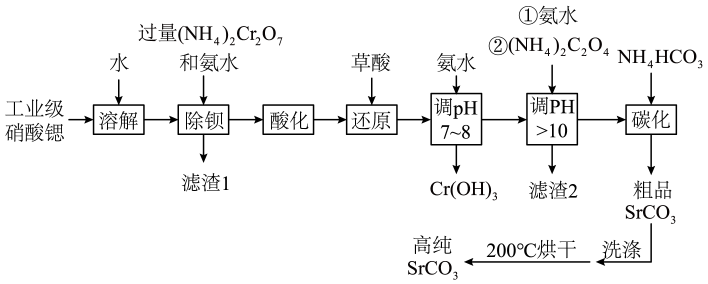
已知:①BaCrO4不溶于水,在水溶液中与Ba2+不能结合。
②在碱性条件下不能转化为Cr3+。
③常温下,各物质的溶度积常数如下表所示:
化合物 | Ca(OH)2 | CaC2O4 | Mg(OH)2 | MgC2O4 | SrCO3 |
Ksp近似值 | 4.6×10-6 | 2.2×10-9 | 5.6×10-12 | 4.8×10-6 | 5.6×10-10 |
回答下列问题:

i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡()溶液。
ii.用重铬酸钾()标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时
溶液过量会对测定结果产生影响,分析影响结果及其原因。

①制氢产物主要为 , 写出蒸汽反应器中发生反应的化学方程式。
②工艺中可循环使用的物质是(填化学式)。

回答下列问题:
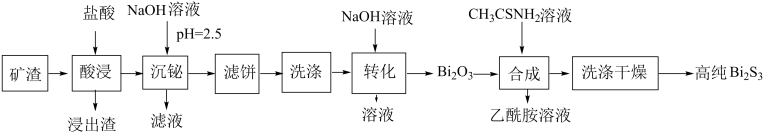
已知:
①乙酰胺()有臭味、有毒,熔点为82.3℃,沸点为221℃,可溶于水。
②常温下, ,
。
③该工艺条件下,相关金属离子形成氢氧化物沉淀的范围如下:
|
离子 |
|
|
|
|
开始沉淀的 |
1.5 |
3.6 |
4.5 |
|
沉淀完全的 |
3.2 |
4.7 |
6.7 |
回答下列问题:
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知原子1的坐标为 , 则原子2的坐标为。
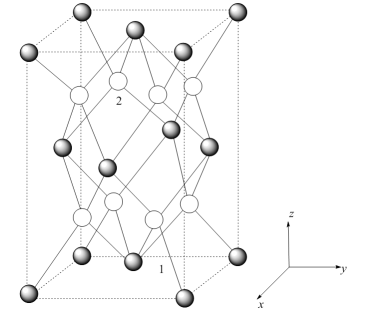
②设阿伏加德罗常数的值为 ,
的式量为
,
则晶体的密度为
(列计算式)。

已知:Ksp[Zn(OH)2]=1.6×10-16;Ksp[Ni(OH)2]=2.8×10-15;Ksp[Fe(OH)3]=2.7×10-39;Ksp[Al(OH)3 =4.6×10-33
回答下列问题:
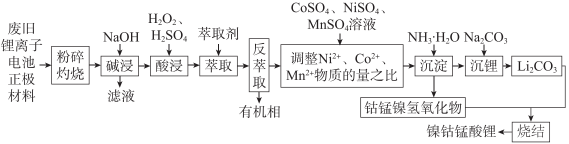
已知:①粉碎灼烧后主要成分是、
、
、MnO、Fe2O3、
;
②萃取剂对选择性很高,且生成的物质很稳定,有机相中的
很难被反萃取
请回答下列问题:
开始沉淀时pH | 1.5 | 3.4 | 6.3 | 6.6 | 6.7 | 7.8 |
完全沉淀时pH | 3.5 | 4.7 | 8.3 | 9.2 | 9.5 | 10.4 |
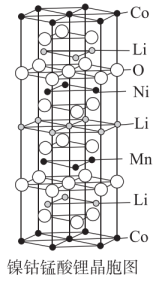
①该物质的化学式为,写出基态Mn原子价层电子的轨道表示式。
②已知晶胞底面边长是anm,高是bnm,一个晶胞的质量为Mg,计算该晶胞的密度(用计算式表示)。

已知:T温度下,磷酸的pKa与溶液的pH的关系如下图。

回答下列问题:
