
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )

则下列说法中错误的是( )
 D . W的氢化物沸点一定比Y的氢化物沸点高
D . W的氢化物沸点一定比Y的氢化物沸点高
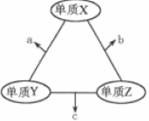
①X 溶于足量水中,得到固体Y和弱碱性溶液 Z。
②取固体 Y,加足量浓盐酸,加热,产生无色气体,析出红色固体,得溶液 W。
下列结论正确的是( )

已知:①所用试剂均过量;②固体 B 的质量小于固体 A。下列说法正确的是( )



①“转化”中用碳酸氢铵和过量氨水的混合溶液浸取天青石精矿,可制得SrCO3沉淀。写出该过程的离子方程式:
②“转化”中维持反应温度70℃且控制氨水过量,氨水过量的主要原因是
③该工艺流程中,可循环利用物质是 (填化学式) 。
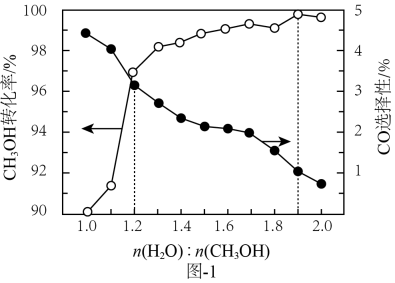
①煅烧温度对SrSO4转化率的影响如图,最佳煅烧温度为

②天青石精矿和煤粉质量比对SrSO4转化率的影响如图,天青石精矿和煤粉质量比增大至5.5:1后,SrSO4转化率下降的可能原因是。


①由图可知,每个Sr2+周围紧邻且等距离的Sr2+个数为。
②已知 =3.2×10-8 , 若一次刷牙所用牙膏含
的质量为2mg,口腔中溶液体积为5mL,刷牙时口腔溶液中氟离子浓度为mol·L-1。


已知:
①;MnO+H2NCOONH4→
 ;
; +2H2O
+2H2O MnCO3↓+2NH3·H2O
②MnO易被空气中氧化;难溶于水;
受热易分解,其他硝酸盐相对难分解。
请回答:

a.将滤纸包放入坩埚后,在泥三角上如装置1朝向摆放;
b.将滤纸包放入坩埚后,在泥三角上如装置2朝向摆放;
c.加热时,不断转动坩埚使滤纸完全灰化;
d.先加热装置3中a处,再加热b处;
e.先加热装置3中b处,再加热a处;
f.将沉淀转移至在石英玻璃管中继续灼烧氧化。

已知:酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
请回答:

已知:(i)氧化性:Co3+>>Fe3+。
(ii)CoCO3、Co(OH)2、黄钠铁矾[NaFe3(SO4)2 (OH)6]均难溶于水。
回答下列问题:


已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1 ×10-22 , Ka1(H2S)=1.0×10-7 , Ka2(H2S)=7.0×10-15 , Ka(CH3COOH)=1.8×10-5。
回答下列问题:
A.ZnO B.ZnCO3 C.Zn(OH)2 D.Zn5(OH)8Cl2·H2O

微粒 | H2S | CH3COOH | CH3COO- |
浓度(mol·L-1) | 0.10 | 0.10 | 0.18 |
则:处理后的溶液pH=,溶液中 c(Zn2+)=mol·L-1。

沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
沉淀完全的pH | 5.2 | 3.2 | 9.4 | 9.5 | 10.1 |

回答下列问题:

名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
电位/V | 0.345 | -0.760 | -0.440 | 0.770 | 1.511 | 0.740 |
①控制电位在0.740-1.511V范围内,在氧化酸浸液中添加催化剂,可选择性还原ClO2 , 该过程的还原反应(半反应)式为。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在V以上。
①净化后的溶液中c(Na2S)达到0.026mol·L-1 , 此时溶液中的c(Cu2+)的最大值为mol·L-1 , 精硒中基本不含铜。([Ksp(CuS)=1.3×10-36])
②硒代硫酸钠酸化生成硒的离子方程式为。

已知:
I. FePO4、CrPO4、AlPO4、Ni3(PO4)2的Ksp依次为1.3 ×10-22、2.4× 10-23、5.8×10-19、5.0×10-31。
II. Cr及其化合物的性质与铝类似。
回答下列问题:

已知:CaHPO3和Ca(OH)2的Ksp分别为1 ×10-4和6 ×10-6 , H3PO3为二元中强酸。
回答下列问题:


已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:


已知:①易水解生成不溶于水的
;
②高温下钛易与N2、H2等反应。
a.H2 b.Ar c.CO2 d.N2
|
|
|
|
|
|
|
熔点/℃ |
|
648.8 |
714 |
1667 |
|
沸点/℃ |
136.4 |
1090 |
1412 |
3287 |

已知:含镍浸出液中阳离子主要有Ni2+、Fe3+、Cu2+、Ca2+、 Mg2+、Zn2+。常温下,部分物质的溶度积常数如下表:
难溶物 | NiS | ZnS | CuS | CaF2 | MgF2 |
溶度积常数 | 1.07× 10-21 | 2.93 × 10-25 | 1.27 × 10-36 | 4 × 10-11 | 7.42 × 10-11 |
请回答下列问题:



已知:Cr及其化合物的性质与铝类似。
回答下列问题:


请回答:

已知:部分阳离子以氢氧化物形式沉淀时溶液的范围如下表:
沉淀物 | ||||
开始沉淀时的 | 7.5 | 2.7 | 7.6 | 6.9 |
完全沉淀时的 | 9.7 | 3.7 | 9.0 | 9.2 |
回答下列问题:
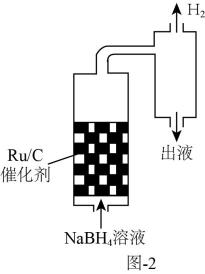
①写出硼氢化钠与水反应的化学方程式:。
②已知粘度越大的液体,阻止微晶下沉的效果越好。相同温度下,将不同浓度的NaBH4溶液以相同的流速通过装有Ru/C催化剂的反应器(装置见图2)。质量分数为10%的NaBH4溶液通过反应器后,测得出液口溶液粘度为4.68mPa·s;质量分数为15%的NaBH4溶液通过反应器后,测得出液口溶液粘度为10.42mPa·s。不同质量分数的溶液反应50小时后,Ru/C催化剂的活性在15%的NaBH4溶液中大于10%的NaBH4溶液的原因是。

①若使用H218O代替H2O分解制氢,则获得的氧气可能是(填字母)。
a.O2 b.18O2 c.Ol8O
②补充完成TiO2材料光催化分解水制氢的过程描述:在紫外光的照射下,TiO2材料的VB端将电子转移至CB端,。

已知:①“浸取”后溶液中的阳离子主要是[ Zn( NH3)4]2+、[Cu(NH3)4]2+。
②25 ℃时Ksp(ZnS)= 1.6×10-24 ;深度除杂标准:溶液中回答下列问题:
[Cu(NH3)4]2+ +4H2O Cu2+ +
K1=a
[Cu(NH3)4]2++S2- +4H2OCuS↓+
K2=b
(NH4)2S的加入量对锌的回收率及铜锌比
的影响如图所示。

①当(NH4)2S加入量超过100%时,锌的回收率下降的可能原因是(用离子方程式表示)。
②(NH4)2S较为合理的加入量约为120%,理由是。
③室温下,向“浸取”液中加入一定量(NH4)2S固体,“深度除铜”后,测得溶液中 c(Cu2+)为1.0×10-8 mol·L-1 , 此时溶液中c(S2- )为mol·L-1(用含a、b的代数式表示,忽略S2-水解)。