X | |||
Y | Z |





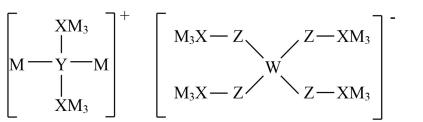


| 选项 | ① | ② | ③ | 实验目的 | |
| A | 浓 | 蔗糖 | 品红溶液 | 检验是否有 | |
| B | 稀 | 某盐溶液 | 澄清石灰水 | 检验盐溶液中是否含有 | |
| C | 浓盐酸 | | | 比较非金属性:Cl与S | |
| D | 浓 | 浓盐酸 | | 比较 |

①A在元素周期表中的位置是。
②下列说法正确的是(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B 的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为。
①该气体分子的电子式为。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. (任写一种)。

i:2Fe2++ PbO2+4H++SO42−=2Fe3++PbSO4+2H2O ii: ……
① 写出ii的化学方程式:。
② 请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入溶液,溶液无颜色变化,再加入少量PbO2 , 溶液变为色。
B.向a得到的溶液中加入,溶液恢复原来的颜色。

①嘌呤中所有元素的电负性由大到小的顺序。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③吡啶结构中N 原子的杂化方式。
④分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为。
①在反应CO 转化成CO2 的过程中,下列说法正确的是。
A.每个分子中孤对电子数不变
B.分子极性变化
C.原子间成键方式改变
D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因。

A.CO32-
B.NO3-
C.NCl3
D.SO32-

①X的三溴化物分子中X原子的杂化方式为,R的三溴化物分子的空间构型的名称为。
②合成XR的化学方程式为。
 该晶体中分子的配位数为,若晶胞的棱长为a nm,阿伏加德罗常数的值为NA , 晶体的密度为g/cm3。
该晶体中分子的配位数为,若晶胞的棱长为a nm,阿伏加德罗常数的值为NA , 晶体的密度为g/cm3。
某化工生产的核心环节的反应为:2MN2(g) + N2(g) ⇌ 2 MN3(g) + Q(Q>0)
回答下列问题:

A.离子键
B.极性键
C.配位键
D.氢键
E.金属键


