

(ⅰ)I2(?)+H2(g) 2HI(g)+9.48 kJ (ⅱ)I2(?)+H2(g)
2HI(g)-26.48 kJ

①H2(g) + I2(?) 2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
下列判断正确的是( )
步骤①:2Fe3+(aq)+H2O2(aq)=2Fe2+(aq)+O2(g)+2H+(aq)步骤②:

下列有关H2O2分解反应说法错误的是( )
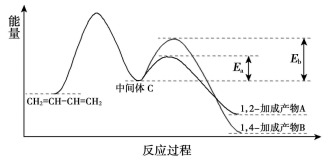


2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1 452kJ•mol﹣1
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1
下列说法正确的是( )


离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(mol•L﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式.增加压强,NO的转化率(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是.
在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压p0如图所示.
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”、“不变”或“减小”).
②反应ClO2﹣+2SO32﹣═2SO42﹣+Cl﹣的平衡常数K表达式为.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是.
②已知下列反应:
SO2(g)+2OH﹣(aq)═SO32﹣(aq)+H2O(l)△H1
ClO﹣(aq)+SO32﹣(aq)═SO42﹣(aq)+Cl﹣(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42﹣(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO﹣(aq)+2OH﹣(aq)═CaSO4(s)+H2O(l)+Cl﹣(aq)的△H=.
已知:
化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/ | 360 | 436 | 431 | 176 |
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。

实验编号 | 反应物组成 |
a | 0.20gCaO粉末、5.0mL |
b | 0.15gAl粉、5.0mL |
c | 0.15gAl粉、5.0mL饱和石灰水 |
d | 0.15gAl粉、5.0mL石灰乳 |
e | 0.15gAl粉、0.20gCaO粉末 5.0mL |

已知:I.
II.
III.
①实验b中,的变化说明Al粉与
在该条件下(填“反应”或“不反应”)。
②实验c中,前3min的有变化,其原因是;3min后
基本不变,其原因是。
③实验d在10min内温度持续升高的原因是。
④实验e中发生的总反应可表示为: , 其
。
五组实验对比,e放热效果最好。
化学键 | ||||
键能 | 243 | 463 | 431 | 496 |
请根据表中数据计算。

①M、N点对应的平衡常数(填“>”、“<”或“=”)
。
②点时
的转化率为(保留三位有效数字)%。
③点时的总压强为
,
为用平衡分压代替平衡浓度表示的平衡常数(分压
总压
物质的量分数),则温度
下的平衡常数
为
。
标准状态下,下列物质气态时的相对能量如下表:
物质(g) | O | H | HO | |||
能量/ | 249 | 218 | 39 | 0 | -136 | -242 |
反应2:
反应3:
在一定压强下,随着温度升高,气体中CO与的物质的量之比(填“不变”、“增大”、“减小”)。
当起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的
、在
下的
如图所示。当
的平衡转化率为1/3时,反应条件可能是。

T(K) |
| 甲醇选择性(%) |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的中转化为甲醇的百分比。
表中数据说明,升高温度,的实际转化率提高而甲醇的选择性降低,其原因是。

①该反应的活化能
②当使用更高效催化剂时,画出与
的关系图。
共价键 | |||||
键能/ kJ∙mol-1 | 391 | 160 | 945 | 498 | 467 |
根据表格数据,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= kJ∙mol-1。
①a点时:v正(NO) (填“>”、“<”或“=”) v逆(NO)。
②bc段NO的转化率随温度升高而降低,可能的原因是。(任答一点)


①0~10min内NO2的分压变化速率为kPa∙min-1。
②该温度下,平衡常数Kp=kPa。(提示:用气体分压计算的平衡常数为Kp , 气体分压=总压×物质的量分数)
①其他条件不变,反应达到平衡后,NH3的转化率随着条件X的增大而增大,则X可能是。(答一种即可)
②升高温度,k逆增大的倍数 k正增大的倍数(填“>”、“<”或“=”)
a.沿玻璃棒缓慢倒入 b.分三次倒入 c.一次迅速倒入
②
③
碳与水蒸气反应制氢气的总反应热化学方程式是。

反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g)
在恒压条件下,起始n(CO2):n(H2)=1:3时,平衡时CO2的转化率和CH3OH的选择性随温度变化如图-1所示。CH3OH的选择性=100%。

①已知键能总和:=2798
。则
=。
②温度高于280℃时,曲线Y随温度的升高而升高的原因是。



①t时刻,CO气体流出速率为0的原因
②氢气的流出速率保持为CH4流入速率的2倍的原因
I.C2H6(g)C2H4(g)+H2(g) △H1
II.2C2H6(g)+O2(g)2C2H4(g)+2H2O(g) △H2<0
①已知键能:E(C-H)=413.4kJ•mol-1 , E(H-H)=436kJ•mol-1 , 生成1mol碳碳π键放出的能量为267.3kJ,则△H1=kJ•mol-1。
②一定温度下,通入p(C2H6):p(O2):p(N2)=10:5:85的混合气体,发生上述反应,测得各组分气体的分压随时间的变化关系如图所示。

0~2.5min内,O2的平均速率为kPa•min-1;反应一段时间后,C2H6和O2的消耗速率比小于2:1的原因为。
③通过比较反应I、II的热效应,氧化脱氢法的优点为。
III.C2H2(g)+H2(g)C2H4(g) △H3<0
IV. C2H2(g)+2H2(g)C2H6(g) △H4<0
保持压强为20kPa条件下,按起始投料n(C2H2):n(H2)=1:2,匀速通入装有催化剂的反应器中发生反应III和V,测得不同温度下C2H2和H2的转化率如图实线所示(图中虚线表示相同条件下平衡转化率随温度的变化)。

①表示C2H2转化率的曲线是(填“m”或“n”)。
②温度高于T2时,曲线m、n几乎重合的原因是。
③T1时,两种物质的转化率分别为0.75、0.5,反应IV的平衡常数Kp=kPa-2。

反应ⅲ的 , 其对应的曲线为(填“a”或“c”)。

①图中代表的曲线为(填“m”或“n”)。
②解释150~250℃范围内转化率随温度升高而降低的原因。
③下列说法错误的是(填字母)。
A.的平衡转化率始终低于
的
B.温度越低,越有利于工业生产
C.加入选择性高的催化剂,可提高的平衡转化率
D.150-400℃范围内,温度升高,的平衡产量先减小后增大
④270℃时CO的分压为,反应ⅱ的平衡常数为(列出算式)。
Ⅱ.超干重整
得到的CO经偶联反应可制得
(草酸)。

Ⅲ.利用电池(工作原理如下图所示)能有效地将
转化成化工原料草酸铝

已知:电池的正极反应式:(草酸根)正极反应过程中,
起催化作用,催化过程可表示为:①
②……

写出该反应的热化学方程式:。

①第一步反应为反应(填“放热”或“吸热”),原因是。
②写出第二步反应的热化学方程式。
③结合两步反应过程,全部氧化成
时的
。

a.上述循环过程中共涉及4种能量转化形式
b.用替代反应II中
, 反应焓变为
, 则
c.上述循环过程中物质转化的作用是传递能量