a.CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g) △H1=+256.6kJ·mol-1
b.2CH3CH2OH(g)+O2(g)⇌6H2(g)+4CO(g) △H2=+27.6kJ·mol-1
则下列说法正确的是( )

下列说法正确的是( )
②6CO2(g)+6H2O(g)=C6H12O6(s)+6O2 △H2
③2H2O(g)=2H2(g)+O2(g) △H3
④2CO2(g)+6H2(g)=C2H5OH(l)+3H2O △H4
下列有关说法正确的是( )
②CO(g)+ O2(g)=CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+ O2(g)=H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+ O2(g)=H2O(l) ΔH4=-d kJ·mol-1 下列叙述正确的是( )


①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol﹣1
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJ•mol﹣1
下列说法正确的是( )
 C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+
C . CH3OH转变成H2的过程一定要吸收能量
D . 根据②推知反应CH3OH(l)+ 化学键 | Si﹣Cl | H﹣H | Si﹣Si | H﹣Cl |
键能(kJ/mol) | 360 | 436 | 176 | 431 |

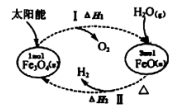
过程Ⅰ:……
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+129.2 kJ·mol﹣1
下列说法正确的是( )
化合物 | 燃烧热 | 化合物 | 燃烧热 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 2﹣甲基丁烷 | 3531.3 |
下列表达正确的是( )
Ⅰ.
Ⅱ.
①下列操作中,能提高平衡转化率的是 (填标号)。
A.增加用量 B.恒温恒压下通入惰性气体
C.移除 D.加入催化剂
②恒温恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,的转化率为
,
的物质的量为
, 则反应Ⅰ的平衡常数
(写出含有α、b的计算式;对于反应
,
, x为物质的量分数)。其他条件不变,
起始量增加到
, 达平衡时,
, 平衡体系中
的物质的量分数为(结果保留两位有效数字)。

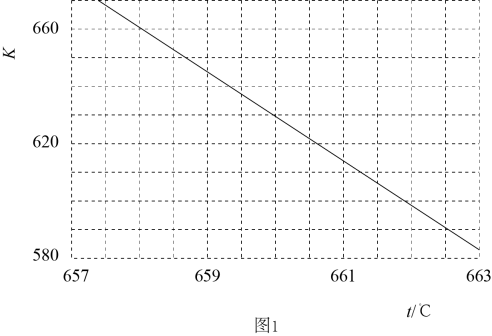
①若反应为基元反应,且反应的与活化能(Ea)的关系为
。补充完成该反应过程的能量变化示意图(图2)。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入和
, 反应平衡后测得容器中
。则
的转化率为,反应温度t约为℃。
催化剂 | t=350℃ | t=400℃ | ||
催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
在选择使用催化剂Ⅰ和350℃条件下反应,生成
的平均反应速率为
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是。
①已知
物质 | ||
标准燃烧热 | -285.8 | -283.0 |
则表示燃烧热的热化学方程式为。
②在恒温恒容装置中通入等体积和
, 发生上述反应,起始压强为p,
的平衡转化率为α,达平衡时,容器内总压强为,该反应的平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①上述反应的Arrhenius经验公式实验数据如图中曲线a所示,已知Arrhenius经验公式(
为活化能,k为速率常数,R和C为常数)。反应的活化能
kJ⋅mol
。当改变外界条件时,实验数据如图中曲线b所示,则实验可能改变的外界条件是。

②在恒容密闭容器中,起始压强相同,反应温度、投料比对
平衡转化率的影响如图所示。则
0(填“>”或 “<”,下同);a3;M、N两点的反应速率
。

③常压某温度下,按(总物质的量为4a mol)的投料比充入密闭容器中发生反应。
随时间(t)的变化趋势如图中曲线A所示。其它条件相同,若将容器的体积改为原来的一半,
时刻
随时间(t)的变化趋势曲线为(填B、C或D)。

方法1:化学还原CO2制备CH3CH2OH。
已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=-484.0kJ·mol-1
②C2H5OH(g)完全燃烧的能量变化如图所示。

容器 | 甲 | 乙 |
条件 | 恒温、恒容 | 绝热、恒容 |
平衡常数K | K甲 | K乙 |
达到平衡时所用时间/min | t甲 | t乙 |
则K甲(填“>”、“<”或“=”,下同)K乙;t甲t乙。

在m、n、p点中,CO2的转化率最大的是(填字母)点。在该温度下,平衡常数K为。

化学键 | O=O | H—H | O—H |
键能E/(kJ·mol-1) | a | b | c |
则氢气燃烧热的△H=kJ/mol(用含a、b、c代数式表示)
①反应平衡常数K=。(结果保留2位有效数字)
②保持K不变,提高CO平衡转化率措施有:。(任意一条)
③由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为。(填字母)

④研究表明,CO催化变换反应的速率方程为:v=k[x(CO)•x(H2O)-],式中,x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,KP为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的KP(填“增大”或“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是。

利用电解原理,将氨转化为高纯氢气,其装置如图所示。阳极的电极反应式为。

主反应a:
副反应b:
副反应c:
已知:主反应选择性指发生主反应所消耗的 在全部所消耗的
中占有的比例。
回答下列问题:

①反应c的 0(填“大于”、“等于”或“小于”)。
②在该催化剂作用下, 投料比为2,
时主反应a的选择性为60%,则体系达平衡后
的体积分数为%(保留到小数点后一位)。
③根据图像,选择合成体系适宜的反应条件为,原因是;相同温度下,随着 投料比增加,主反应的反应速率先加快后减慢,导致主反应的反应速率减慢的主要原因可能是。
反应1:2CH4(g)C2H2(g)+3H2(g) ΔH1
反应2:2CH4(g)C2H4(g)+2H2(g) ΔH2
请回答下列问题:
|
物质 |
CH4(g) |
C2H2(g) |
C2H4(g) |
H2(g) |
|
燃烧热(ΔH)/(kJ/mol) |
-890.3 |
-1299.5 |
-1411.0 |
-285.8 |
①写出表示C2H2(g)燃烧热的热化学方程式:。
②上述反应中,ΔH1-ΔH2=kJ·mol-1。
③已知反应1的ΔS=+220.2 J·mol-1·K-1 , 则下列所给温度能使该反应自发进行的是(填标号)。
A.0℃ B.25℃ C.1250℃ D.2 000℃

①图中随着通入气体中CH4的物质的量分数的增大,甲烷的平衡转化率降低的主要原因是。
②已知M点乙炔的选择性为75% [乙炔的选择性=×100%]。该温度下,反应2的平衡常数Kp=kPa(结果保留2位有效数字,Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。

主要热化学反应如下:
I.2Ni(s)+O2(g)=2NiO(s) ∆H=-479.8kJ∙mol-1
II.CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ∆H=+68.9kJ∙mol-1
①CH4的燃烧热是。
②与直接燃烧CH4相比“化学链燃烧”的优点为。
a.燃烧等质量的CH4 , 放出的热量多
b.有利用于二氧化碳的分离与回收
c.燃烧等质量的CH4 , 消耗的O2少
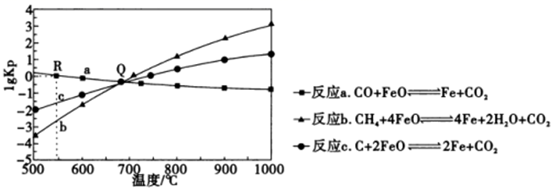
①R点对应温度下向某恒容密闭容器中通入1.0molCO和0.2molCO2 , 并加入足量的FeO,只发生反应a:CO(g)+FeO(s)=CO2(g)+Fe(s),则CO的平衡转化率为。
②若某恒容密闭容器中只发生反应b和c,平衡时对应上图中Q处时,容器中气体分压p(X)间应满足的关系是。
①T℃下该反应的Kp=。
②其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率(填“增大”“减小”或“不变”)。
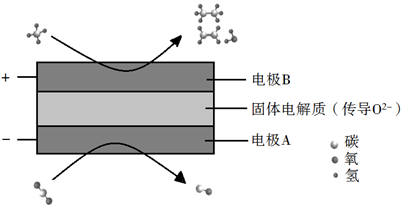
①写出生成乙烯的电极反应式为:。
②若生成的乙烯和乙烷的体积比为1:2,则消耗的CH4和CO2体积比为。
①CH4燃烧反应中,反应物的总能量生成物的总能量(填“>”、“<”或“=”)。
②已知CH4(g)的燃烧热为890.3kJ·mol-1 , 甲烷完全燃烧的热化学方程式为。
①若移出部分NH3 , 则正反应速率(填“增大”或“减小)。
②若正反应为放热反应,则降低温度,平衡向(填“正反应“或“逆反应”)方向移动。
③若压缩容器容积,反应的平衡常数(填字母代号)。
A.增大B.减小C.不变
①钢铁在潮湿的空气中易腐蚀,当生铁表面吸附的水膜酸性很强时,主要发生的是(填字母代号)。
A.吸氧腐蚀B.析氢腐蚀C.化学腐蚀
②铁在工业电解食盐水中用作电极,电解时,铁电极与电源(填“正”或“负)极相连,阳极的电极反应式是。
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJ•mol-1、-b kJ•mol-1、-c kJ•mol-1;
②H2O (l) =H2O(g); △H=+dkJ•mol-1
则△H1= (用含字母a、
B、
C、d的代数式表示)kJ•mol-1。

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2 (填“>”“<”或“ = ”)0。
②下列说法正确的是 (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 0〜3 min内用CH3OH表示的反应速率v(CH3OH)=mol • L-1·min-1。
④ 200℃时,该反应的平衡常数K =。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡(填“正向”、“逆向”或“不”)移动。

物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
①在200℃时,测出乙烷的量比乙烯多的主要原因是。
②在600℃后,乙烯的体积分数减少的主要原因是。


通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为极,左端碳棒上的电极反应为,右池中的c(NaOH):c(Na2S) (填“增大”、“基本不变”或“减小)。
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2 , 化学方程式如下:
2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | … |
c(NO)/mol•L﹣1 | 1.00×10﹣3 | 4.00×10﹣4 | 1.70×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 | … |
O3氧化NO结合水洗可产生HNO3和O2 , 每生成1mol的HNO3转移 mol电子.

①判断该反应达到平衡状态的标志是(填标号)。
a.浓度之比为2∶2∶2∶1
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.容器内混合气体的平均摩尔质量保持不变
e.的生成速率和
的生成速率相等
②的平均反应速率为
。该反应的压强平衡常数
(用分压代替浓度计算,分压=总压×物质的量分数。用含
的代数式表示)。
③若在相同时间内测得的转化率随温度的变化曲线如图甲所示,
的转化率在
之间下降由缓到急的原因是。


①气体X为,膜Ⅰ适合选用(填“阳离子”或“阴离子”)交换膜。
②稳定工作时溶液的浓度(填“增大”“减小”“不变”“无法判断”)。
③若制得 , 饱和食盐水质量减小g。
1mol分子中的化学键断裂时需要吸收的能量 | 436 | 230 | 369 |
写出1mol和1mol
化合时的热化学方程式:。
①H2O(g)=H2(g)+O2(g)ΔH=+241.8kJ/mol
②C(s)+O2(g)=CO(g)ΔH=-110.5kJ/mol
③C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol
请填写下列空白。
2SO2(g)+O2(g)2SO3(g) ∆H1=-197kJ∙mol-1
H2O(g)H2O(l) ∆H2=-44kJ∙mol-1
2SO2(g)+O2(g)+2H2O(g)= 2H2SO4(l) ∆H3=-545kJ∙mol-1
则SO3(g)与H2O(l)反应的热化学方程式是。
物质 | H2(g) | O2(g) | H2O(g) | H2O(l) |
相对能量(kJ·mol-1) | 0 | 0 | -242 | -286 |
①表示H2(g)燃烧热的热化学方程为。
②0.5molH2O(g)转化为H2O(l)需要(填“吸收”或“放出”)kJ的热量。
Ⅰ.2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
Ⅱ.C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
根据盖斯定律计算CO(g)+O2(g)=CO2(g) △H=kJ·mol-1。
①
②
③
+
④
请根据“原子经济”的思想完成上述步骤③的化学方程式:;根据“绿色化学”的思想评估该方法制的主要缺点:。

①X是电源的极。
②阴极的反应式有:和。
③阴、阳两极产生的气体的物质的量之比为。