

下列说法正确的是


反应①:O3→O2+O• (快)
反应②:O3+O•→2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl•)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )

下列说法正确的是( )



 更稳定
更稳定

a.升高温度 b.增大压强 c.加入催化剂


①图中压强由小到大的顺序为,判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、
时,氮气的转化率
。该温度时,反应
的平衡常数
(化为最简式)。
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
c)CH4(g) C(s)+2H2(g) ∆H3
d)2CO(g) CO2(g)+C(s) ∆H4
e)CO(g)+H2(g) H2O(g)+C(s) ∆H5
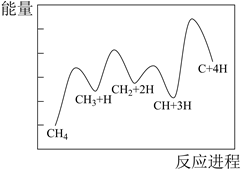
①反应a、c、e中,属于吸热反应的有(填字母)。
②反应c的相对压力平衡常数表达式为K =。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程。
H2(g)+ O2(g)=H20(1) △H1=-286kJ·mol-1
H2(g)+ O2(g)=H2O2(l) △H2=-188 kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=kJ·mol-1。不同温度下
过氧化氢分解反应的平衡常数K313KK298K (填“大于"“小于”或“等于”)。
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% |
无 | __ | 2 | Fe3+ | 1.O | 15 |
Al3+ | 10 | 2 | Cu2+ | O.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是。贮运过氧化氢时,可选用的容器材质为(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁


该历程中反应速率最慢的步骤的方程式为

①以下叙述不能说明该条件下反应达到平衡状态的是(填字母)。
a.氨气的体积分数保持不变
b.容器中保持不变
c.气体平均相对分子质量保持不变
d.气体密度保持不变
e.
②反应20min时达到平衡,则0~20min内 , 该反应的
(保留小数点后两位)。(
为以分压表示的平衡常数)
③若起始条件相同,在恒容容器中发生反应,则达到平衡时的含量符合图中点(填“d”“e”“f”或“g”)。

该反应的反应历程及反应物和生成物的相对能量如下图所示:

反应 (填“①”“②”或“③” )是该反应的决速步骤。

图中表示投料比为2:1的曲线的是。
图b中c1= c2= ;晶胞参数为a pm, CsPbBr3的密度为 g·cm-3(列出计算式,设NA表示阿伏加德罗常数的值)。

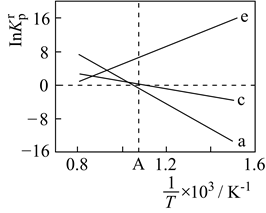
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ·mol-1
反应II:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ·mol-1
反应III:2CO2(g)+6H2(g)=4H2O(g)+C2H4(g) ΔH3=kJ·mol-1

①该反应在低温下是否可以自发进行(填“是”“否”或“无法确定”);
②下列能提高CO2平衡转化率的措施有;
a.降低反应温度
b.使用高效催化剂
c.通入He气体使体系的压强增大
d.以相同的投料比增加反应物的物质的量
③R点处,X2.0(填“>”“<”或“=”);
④若起始加入1molCO2和2molH2 , 则Q点的平衡常数K=;

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①催化剂助剂主要在起作用(填“第i步”或“第ii步”“第iii步”);
②在Fe3(CO)12/ZSM-5中添加助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因是。
 的名称为。
的名称为。

①随着温度的升高,平衡的物质的量分数先增大后减小的原因是。
②a点对应反应的压强平衡常数(保留两位有效数字)。
③在实际生产中,充入一定量(
不参与反应)可以提高丙烯腈的平衡产率,原因是。
反应ⅰ:

反应ⅱ:
恒温恒容条件下,向密闭容器中加入一定量
和
, 图甲为该体系中B、M、C浓度随时间变化的曲线,图乙为反应ⅰ和ⅱ的
曲线(
, k为速率常数,
为反应活化能,R、C为常数)。

①在时刻之后,反应速率
、
、
的定量关系为。
②结合图乙,反应ⅰ、ⅱ正反应的活化能、
的大小关系为(填序号,下同),反应ⅰ、ⅱ的
、
的大小关系为。
a.前者大于后者|b.前者小于后者| c.无法比较
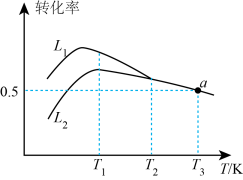
①线(填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1K后曲线L2随温度升高而降低的原因为。
③当温度高于(填“T1”或“T2”)时,可判断反应ii不再发生,a点对应的温度下,丙烯的分压p(C3H6)=kPa(保留3位有效数字,下同),反应i的平衡常数。(已知:分压p分=总压×该组分物质的量分数,对于反应
,
, 其中
、
、
、
为反应平衡时各组分的分压)

已知三步反应的活化能:反应I>反应III>反应II。则催化过程的决速反应为(填“反应I”“反应II”或“反应III”)。

①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=eV/mol(阿伏加德罗常数用NA表示);
②(填“甲酸盐”或“羧酸”)路径更有利于CO2加氢制甲醇反应,对该路径的反应速率影响最大的一步反应是;
③根据势能图,下列说法合理的是(填标号)。
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率

①该反应的活化能Ea=kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与关系的示意图。

CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因。
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=。(列出计算式)


[标准平衡常数 , 其中
为标准压强
,
、p(CO2)、p(CO)和p(NO)为各组分的平衡分压[已知
, 其中p为平衡总压,
为平衡系统中NO的物质的量分数]
①某条件下该反应速率 ,
, 该反应的平衡常数
, 则a=,b=。
②一定温度下,在体积为1L的恒容密闭容器中加入4molNH3和6molNO发生上述反应,若在相同时间内测得NH3的转化率随温度的变化曲线如图,400℃~900℃之间NH3的转化率下降由缓到急的原因是

基元反应 | 正逆反应活化能 | ||
E正反应 | E逆反应 | ||
① | H2O+* | 0 | 67 |
② | H2O*+* | 150 | 0 |
③ | OH*+* | 71 | 67 |
④ | 2H*+* | 74 | 25 |
⑤ | CO+* | 0 | 42 |
⑥ | CO*+O* | 37 | 203 |
⑦ | CO2* | 17 | 0 |

①往3L恒温恒容的密闭容器中加入2.0molH2O(g)和3.0molCO,在D点温度下,经过6min达到平衡,则该过程的平均反应速率v(H2O)=mol/(L·min),此时的平衡常数Kc=。
②平衡从图中B点移动到A点,应改变的条件是,理由为。
③连接图中的点成线,表示相同温度下CO平衡转化率随n(CO):n(H2O)的变化。
④图中A、D两点对应的反应温度分别为TA和TD , 通过计算分析: TA TD (填“大于”“小于”或“等于”)。
i.SiCl4(g)+2H2(g) Si(s)+4HCl(g) △H1=akJ/mol
ii.SiHCl3(g)+H2(g) Si(s)+3HCl(g) △H2=bkJ/mol
回答下列问题:
H2(g)还原SiCl4(g)生成SiH2Cl2(g)的热化学方程式为。

①T2温度下,反应达到平衡时SiHCl3(g)的转化率。
②T2温度下,反应i的标准平衡常数Kθ的计算式为。
(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g)的Kθ=
,其中pθ=106Pa,pG、pH、pD、pE为各组分的平衡分压)。
③△H20(填“>”或“<”),写出推理过程。
④要增大SiCl4(g)的转化率可以采取的措施有(写其中的一条即可)。
已知:R=8.3×10-3kJ/(mol·K);ln10=2.3
①若T1=300K,通过升高温度到595K,才能满足 =108以加快反应速率;
②若T=300K,使用催化剂使活化能降低,满足 =108以加快反应速率,Ea应减小。
上述②中Ea应减小kJ/mol(保留1位小数);对比①和②你得到的结论是。
i.CH4(g)⇌C(s)+2H2(g) △H1=+75.0kJ/mol
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=+41.0kJ/mol
iii.CO(g)+H2(g)⇌C(s)+H2O(g) △H3=-131.0kJ/mol

①该历程中最大能垒E(正)=eV/mol;
②其它条件相同时,催化重整的主反应在不同催化剂下反应相同时间,CO的产率随反应温度的变化如图所示:

B是合金催化下CO的产率随温度的变化曲线,A、B曲线到达W点后重合,请解释原因。

①A、B两点对应的CO正反应速率v正(A)v正(B)(填“<”“=”或“>”,下同),B和C两点对应的反应温度TBTC。
②已知反应速率v正=k正x(CO)x(H2),v逆=k逆x(H2O),k为反应速率常数,x为气体的体积分数,在达到平衡状态为D点的反应过程(此过程为恒温)中,当某时刻CO的转化率刚好达到60%时, =。(用含k正和k逆的式子表示)

A.三种反应历程中,反应速率最快
B.过渡态1比另两种过渡态稳定
C.降低温度和增大压强都有利于提高反应物平衡转化率
D.同温同压下,只要起始投料相同,相同时间三种途径的产率一定相同

①时,反应
后到达点B,此时甲基叔丁基醚的体积分数为(保留3位有效数字)
②A、B、C三点中,正反应速率最大的是。
③比较A、B、C三点的平衡常数 , 从大到小的顺序是。
④已知对于反应 , 标准平衡常数
, 其中
为各组分的平衡分压,分压=总压×该组分物质的量分数,
。在
时(如图),将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为
),甲醇的平衡分压为
, 反应的标准平衡常数
。(保留1位小数)