| | 0 | 600 | 1200 | 1710 | 2220 | 2820 | x |
| | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 | 0.12 |
下列说法正确的是( )
组别 | 温度/K | 时间/min 物质的量/mol | 0 | 10 | 20 | 40 | 50 |
① | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | ||
② | 0.50 | 0.30 | 0.18 | M | 0.15 |
下列说法不正确的是( )
已知:①v正=k正·x(CO)·x2(H2),v逆=k逆·x(CH3OH),其中v正、逆为正、逆反应速率,k正、k逆·为速率常数,x为各组分的体积分数。
②K,为以分压表示的平衡常数,气体分压=气体总压x体积分数
下列相关说法错误的是( )

| 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | n(A)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(A)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
已知: 的沸点为
,固体杂质不参与反应。
第一阶段:将粗镍与 反应转化成气态
;
第二阶段:将第一阶段反应后的气体分离出来,加热至 制得高纯镍。
下列判断正确的是( )



下列说法正确的是( )
| 时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
| n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
| n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
下列说法正确的是( )

下列推论不合理的是( )
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| A | B | A | B | ||
| 容器Ⅰ | 300 | 3 | 1 | 0.8 | |
| 容器Ⅱ | 300 | 6 | 2 | ||
| 容器Ⅲ | 240 | 3 | 1 | 0.4 | |
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 |
|
|
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
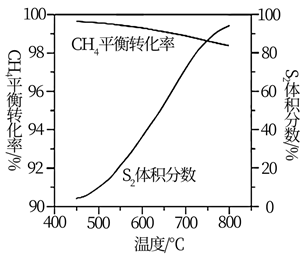
①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
反应Ⅰ: ![]() +CH3OH
+CH3OH
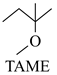 △H1
△H1
反应Ⅱ: ![]() +CH3OH
+CH3OH
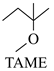 △H2
△H2
反应Ⅲ: ![]()
![]() △H3
△H3
回答下列问题:
A.<-1 B.-1~0 C.0~1 D.>1
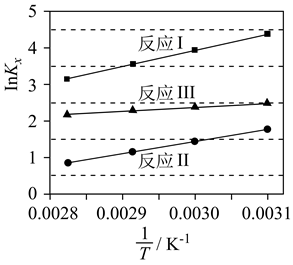
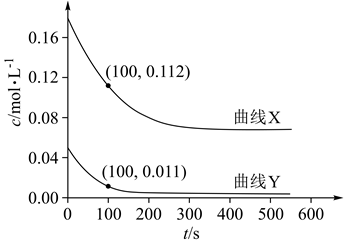
①该温度下反应的平衡常数为。
②平衡时 的转化率为。
①下列说法正确的是。
A.须采用高温高压的反应条件使 氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和 的转化率
D.在吸收塔中宜采用水或稀硫酸吸收 以提高吸收速率
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是。
A. B.
C.
D.
E.
F.
G.

③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应 的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图(标明曲线Ⅰ、Ⅱ)。


Ⅰ.
Ⅱ.①;
Ⅲ. ;
Ⅳ.②。
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
c)CH4(g) C(s)+2H2(g) ∆H3
d)2CO(g) CO2(g)+C(s) ∆H4
e)CO(g)+H2(g) H2O(g)+C(s) ∆H5
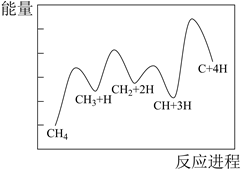
①反应a、c、e中,属于吸热反应的有(填字母)。
②反应c的相对压力平衡常数表达式为K =。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程。

A.d点:
B.c点与a点相比,增大,
减小
C.若注射器隔热,没有能量损失,会导致反应温度发生变化,则b、c两点的平衡常数
D.若在注射器中对反应进行完全相同的操作,最后能得到相似的透光率变化趋势图像
在100℃时,将的
气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表数据。
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
0.40 | 0.26 | |||||
0.00 | 0.05 | 0.08 | 0.08 | 0.08 |


A.d点:
B.c点与a点相比,增大,
减小
C.若注射器隔热,没有能量损失,会导致反应温度发生变化,则b、c两点的平衡常数
D.若在注射器中对反应进行完全相同的操作,最后能得到相似的透光率变化趋势图像
在100℃时,将的
气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表数据。
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
0.40 | 0.26 | |||||
0.00 | 0.05 | 0.08 | 0.08 | 0.08 |

|
物质 |
O2(g) |
SO2(g) |
SO3(g) |
|
|
0 |
-296.8 |
-395.7 |
 A.温度 B.压强 C.
A.温度 B.压强 C. D.与催化剂的接触面积

①反应在D点达到平衡后,若此时升高温度,同时扩大容器体积使压强减小,在重新达到平衡过程中,D点会向A~G点中的点移动。
②某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图3所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因是;a点(填“是”或“不是”)对应温度下的平衡脱氮率,理由是。


①阴极区的电极反应式为
②NO被吸收转化后的主要产物为 , 若通电时电路中转移了0.3mole- , 则通电过程中理论上被吸收的NO在标准状况卜的体积为mL。
②
则kJ/mol。

①a点的b点的
(填“>”“<”或“=”)。
②c点(填“是”或“否”)一定是平衡状态,理由是。
③研究表明氧气的存在对于NO的还原有抑制作用,原因是。

主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) △H1=-156.9 kJ·mol-1
副反应:CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
已知2H2(g)+O2(g)2H2O(g) △H3= -395.6 kJ·mol-1。
CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=。
573 K时,在体积为2 L的刚性容器中,投入2 mol CO2和6 mol H2 , 合成总反应达到平衡时,CO2的平衡转化率为60%。

①该反应的平衡常数K=L2/mol2 (保留1位小数)。
②为了提高CO2的平衡转化率可以采取的措施有 ( 填写两项措施)。
③图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线 (填 “m”或“n”)。
④测得在相同时间内,不同温度下H2的转化率如图2所示,v(a)逆v(c)逆(填“>”“<”或“=”)。

I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:

①上图中能够代表k逆的曲线为(填“L1”“L2”或“L3”“L4”)。
②温度为T1时,反应I的化学平衡常数K=
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应I、II的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变

①压强p1、P2、P3由大到小的顺序是。压强为P1时,温度高于570℃之后,随着温度升高CO2平衡转化率增大的原因
②图中点M(500,60),此时压强p1为0.1MPa,CH3OH的选择性为 (选择性:转化的CO2中生成CH3OH和CO的百分比),CO2的平衡转化率为60%。则该温度时反应I的平衡常数Kp=MPa-2(分压=总压×物质的量分数)。
②N2(g)+O2(g)⇌2NO(g)△H2=+179.5kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-112.3kJ·mol-1
NO2与CO反应生成无污染气体的热化学方程式为。
①0~5min内,v(NH3)=mol·L-1·min-1 , NO的平衡转化率=%。
②450℃时,该反应的压强平衡常数Kp=(填含p的代数式,Kp为以分压表示的平衡常数,分压=总压×气体组分物质的量分数)MPa。

该吸收过程中,Ce3+/Ce4+的作用是,其中反应II的离子方程式为。

①能够说明上述可逆反应达到平衡状态的选项是(填标号)》
A.密度不再改变 B.平均摩尔质量不再改变 C.CO2和H2的分压相等
D.CH4的分压不再改变 E.
②研究表明CO的生成速率 , 某时刻测得
, 则
,
。
③达到平衡后测得体系总压是起始时的倍,则该反应用分压表示的平衡常数
(计算结果保留三位有效数字)。
④温度对产物流量及平衡转化率的影响如图乙所示,可知反应0(填“>”或“<”),原因是。
3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) ΔH1
3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) ΔH2
则反应:2CaSO4(s)+S(s)=2CaO(s)+3SO2(g) ,ΔH=(用ΔH1和ΔH2表示)。

①温度低于800℃时,主要的还原产物是一种硫的最低价盐,该物质的化学式是。
②1150℃下,向盛有足量CaSO4的真空恒容密闭容器中充入一定量CO,反应体系起始压强为0.1a MPa,主要发生反应:CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g)。该反应达到平衡时,c(SO2)=8.0×10-5mol·L-1 , CO的转化率为80%,则初始时c(CO)=mol·L-1 , 该反应的分压平衡常数KP=MPa(用含a的代数式表示;分压=总压×物质的量分数;忽略副反应)。

已知:①C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) ΔH1=-2765.0kJ/mol
②2O2(g) +N2(g)=N2O4(l) ΔH2=-19.5kJ/mol
③H2O(g)= H2O(l) ΔH3=-44.0kJ/mol
则C2H8N2(1)+2N2O4(1)=3N2(g)+2CO2(g)+4H2O(g)的ΔH为。
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是____
①达到平衡后,仅升高温度,k正增大的倍数(填“大于”“小于”或“等于”)k逆增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0kPa。达平衡时压强为0.9p0kPa,则。
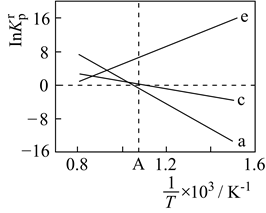
①3N2H4(1)=4NH3(g)+N2(g) ΔH1 Kp1
②4NH3(g)=2N2(g)+6H2(g) ΔH2 Kp2
绘制pKp1-T和pKp2-T的线性关系图如图所示:(已知:pKp=-1gKp)

①由图可知,ΔH10(填“>”或“<”)
②反应3N2H4(1)=3N2(g)+6H2(g)的K=(用Kp1、Kp2表示);该反应的ΔH0(填“>”或“<”),写出推理过程