
实验 | 实验操作和现象 |
1 | 测定0.10mol•L-1NaHCO3溶液的pH约为8 |
2 | 测定0.10mol•L-1HCN与0.05mol•L-1NaOH溶液等体积混合,测得混合溶液的pH>7 |
3 | 向NaClO溶液中通入少量的CO2 , 测得pH降低 |
4 | 向0.01mol•L-1Na2CO3溶液中加入等体积0.02mol•L-1CaCl2溶液,产生白色沉淀 |
下列所得结论正确的是( )


| 现象或操作 | 解释 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去 | SO2具有漂白性 |
| B | 配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe3+水解,并防止Fe3+变质 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 向含有Cu(OH)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀 | Ksp(Ag2S)<Ksp(CuS) |






已知:在室温下,Ksp(AgBr)=5.4×10 -13 , Ksp(AgCl)=1.8×10 -10
向 BaCl2溶液中加入 AgNO3和 KBr,当两种沉淀刚好共存时,溶液中 = 。
写出简要计算过程:

已知:Li2O•Al2O3•4SiO2+H2SO4(浓) Li2SO4+Al2O3•4SiO2•H2O↓回答下列问题:
A.无焰色反应 B.黄色 C.紫色 D.砖红色

①图中膜a应选用(填“阳离子”或“阴离子”)交换膜。
②各间隔室的排出液中,A为(填“淡化海水”或“浓缩海水”)。
③电渗析法还可用来处理电镀废液,写出用该方法处理含AgNO3废液时所发生反应的化学反应方程式:。
①如果超临界水的电离度变为常温下的100倍,则此时Kw的值为。
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图,其中x为以碳元素计的物质的量分数,如xCO= ,t为反应时间。 CO的分布分数先增后降的原因是。

③不同温度下乙醇的超临界水氧化过程中CO的分布分数随时间变化如图所示,随着温度升高,CO分布分数峰值出现的时间提前且峰值更高的原因是。


已知:25℃,Ksp[Co(OH)2]=4.0×10-15 , lg2=0.3


①加入乙醇的目的是。
②钛酸四丁酯水解产生TiO2和C4H9OH的化学方程式为。
③溶液中Cu2+浓度为0.02 mol·L-1 , 需调节pH小于。(已知Ksp[Cu(OH)2]=2×10-20)

制备Na5PWl1O39Cu/TiO2膜的最佳条件为:培烧温度,Na5PW11O39Cu用量。
①该溶液中离子浓度由大到小排列的顺序为:;
②精确表达下列算式的数学结果:c(Na+)-c(CH3COO-)=;c(OH-)-c(CH3COOH)=。

①几种均为0.1mol/L的电解质溶液的pH随温度变化的曲线如图甲所示。其中符合溶液的pH随温度变化的曲线是(填罗马数字),导致
溶液的pH随温度变化的原因是。
②20℃时,溶液中
。
|
A.溶液中 |
B. |
C.溶液的pH与反应时间t的关系 |
D. |
|
|
|
|
|

的
;利用图中数据计算推测
溶液的酸碱性(写出推理过程和结论)。

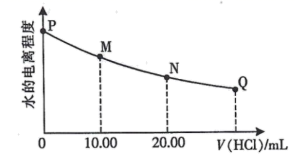
试分析图中a、b、c、d四个点,水的电离程度最大的是点。在b点,溶液中各离子浓度由大到小的排列顺序是。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |

①混合溶液中由水电离出的c(OH-)与0.1mol/LNaOH溶液中由水电离出的c(OH-)之比为。
②已知NH4X溶液呈中性,将HX溶液加入到Na2CO3溶液中有气体放出。试推断NH4HCO3溶液的pH7(填“>”“<”或“=”)。
