 )中含有σ键数目为6 NA
C . 绿矾分解生成16g
)中含有σ键数目为6 NA
C . 绿矾分解生成16g
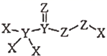 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( )
①1000℃时,CH4、NH3和O2在催化剂作用下可转化为HCN,HCN与NaOH反应可制得NaCN。生成HCN的化学方程式为。
②1mol 含有σ键的数目为。
①该反应的离子方程式为。
②Cu2+可作为上述反应的催化剂。其他条件相同时,总氰化物( 、HCN等)去除率随溶液初始pH变化如图1所示。当溶液初始pH>10时,总氰化物去除率下降的原因可能是。


a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为。

①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为,不同之处为。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、、。
碳及其化合物广泛存在于自然界中,回答下列问题:

①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。