
①2NO(g) N2O2(g)(快)
②N2O2(g)+H2(g) N2O(g)+H2O(g)(慢)
③N2O(g)+H2(g) N2(g)+H2O(g)(快)下列有关说法正确的是( )

下列说法正确的是( )

下列有关说法正确的是( )
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
和
生成
;
分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是填序号
。
活化能:反应
反应
为放热反应,
为吸热反应
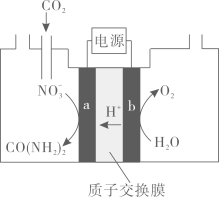
电极
是电解池的极。
电解过程中生成尿素的电极反应式是。
已知:溶液中不能直接用
溶液准确滴定。

消化液中的含氮粒子是。
步骤
中标准
溶液的浓度和消耗的体积分别为
和
, 计算样品含氮量还需要的实验数据有。
①
②
③
计算热分解反应④
的
。

①越小,
平衡转化率,理由是。
②对应图中曲线,计算其在
之间,
分压的平均变化率为
。
方法I:氨热分解法制氢气
相关化学键的键能数据
|
化学键 |
| | |
| 键能 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将 分解为
和
。回答下列问题:
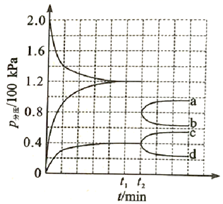
①若保持容器体积不变, 时反应达到平衡,用
的浓度变化表示
时间内的反应速率
(用含
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应
,
,其中
,
、
、
、
为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。

KOH溶液KOH溶液

已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为;图乙中T1温度时,三条曲线几乎交于一点的原因是。
I.
II.
①则的
, 其中反应I能自发进行的条件是。
②保持温度T不变时,在容积不变的密闭容器中,充入一定量的及
, 起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
|
|
|
|
| 总压强/kPa | |
起始 | 0.5 | 0.9 | 0 | 0 | 0 | |
平衡 | m | 0.3 | p |
若反应I、II均达到平衡, , 则表中m=;反应I的平衡常数
(用含p的代数式表示)
。

已知:的产率
①下列说法正确的是(填标号)。
A.反应过程中,容器内压强不再变化,说明反应I达到平衡
B.反应过程中,气体密度保持不变,说明反应I达到平衡
C.反应过程中,气体的平均摩尔质量保持不变,说明反应I达到平衡
②图中500K以后,的平衡转化率随温度升高而增大的原因是。
已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C |
| 键能/ kJ·mol -1 | 413 | 745 | 436 | 1075 |
则该反应的∆H=。
反应①CO2(g)+H2(g) CO(g) + H2O(g) ∆H1= +41.2 kJ·mol-1
反应②CH4(g)+ O2(g)
CO(g) +2H2(g) ∆H2= -35.6 kJ·mol-1
测得不同温度下反应平衡时各产物产量如图所示。

图中a和b分别代表产物和,当某超高温度,H2O的含量随温度升高而下降的主要原因是。1100K时,CH4与CO2的转化率分别为95%和90%,则CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=(写出计算式)。
|
反应 |
Ⅰ |
Ⅱ |
|
CH4(g) | CO2(g) +C(s) | |
| ∆H (kJ·mol -1) | +75 | -173 |
研究发现,如果反应I不发生积碳过程,则反应II也不会发生积碳过程。因此若保持催化剂的活性。应采取的条件是。如果I、II均发生了积碳反应,通入过量水蒸气能有效清除积碳,反应的化学方程式是。

三个基元反应中,属于放热反应的是(填标号);图中
。

①某条件下该反应速率 ,
,该反应的平衡常数
,则
,
。
②一定温度下,在体积为1L的恒容密闭容器中加入4
和6
发生上述反应,测得
和
的物质的量随时间变化如图。

a点的正反应速率c点的逆反应速率(填“大于”、“小于”或“等于”);测得平衡时体系压强为 ),则该反应温度下
。(用含
的式子表示,只列式不用化简)。若在相同时间内测得
的转化率随温度的变化曲线如下图,400℃~900℃之间
的转化率下降由缓到急的原因是。

|
反应时间t/s |
0 |
100 |
350 |
850 |
2000 |
2500 |
|
气体总压p总/kPa |
50.0 |
55.0 |
65.0 |
83.2 |
125.0 |
125.0 |
①该温度下,反应达到平衡时,CH3OCH3的分解率为;t=350s时,混合气体的平均摩尔质量为(保留三位有效数字)g·mol-1。
②若反应达到平衡后,升高温度,CH3OCH3的浓度增大,则正反应为(填“放热”或“吸热”)反应。
③该温度下,要缩短反应达到平衡所需的时间,可采取的措施是。
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+40.9kJ·mol−1
Ⅲ.CO(g)+2H2(g) CH3OH(g) ΔH3
回答下列问题:

反应类型②:
Ⅰ.2CO2(g)+2H2O(l) CH2=CH2(g)+3O2(g)
Ⅱ.CH2=CH2(g)+H2O(l)=C2H5OH(l)
Ⅲ.2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)
 ①下列有关说法正确的是 (填字母)。
①下列有关说法正确的是 (填字母)。
A.反应Ⅲ是一个放热反应
B.增大氢碳比,可以提高H2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的平衡产率增大
D.平衡常数:K(N)<K(M)
②在总压为2.1MPa的恒压条件下,M点时,CO2的平衡转化率为 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式(只需列式)为Kp= (各气体分压=平衡体系中各气体的体积分数×总压)。
主反应Ⅰ:2CH2=CH2(g)+O2(g) 2
![]() (g)
(g) =-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g) 2CO2(g)+2H2O)(l)
=-1324kJ·mol-1
Ⅲ.2 ![]() (g)+5O2(g)
(g)+5O2(g) 4CO2(g)+4H2O(g)
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。


②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为。
②若平衡后仅升高温度,则下列说法正确的是。
a.x(CH2=CH2)增大,x( ![]() )减小
)减小
b.K正与K逆的比值增大
c.v正减小,v逆增大
d.K正与K逆的比值减小

已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为(选填“阴极”或“阳极”)。
②b电极区域生成环氧乙烷的化学方程式为。
①CO(g)+ O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+ O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+ O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g) CH3OH(g)ΔH=。

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为。
②X轴上b点的数值比a点(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是。

①反应H2(g)+I2(g) 2HI(g)的ΔH (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O 3H++HSO4-+2I- , I2+I-
I3- , 图2中曲线a、b分别代表的微粒是、(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是。
②CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H
该催化重整反应的△H=kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为。

已知b>a>c,则T1T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=(mol2·L-2)

由上表判断,应选择载体为(填化学式),理由是。


该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=(保留1位小数)。
回答下列问题:

该反应分两步进行:
第一步:Co+(s)+N2O(g) CoO+(s)+N2(g) △H1=+15.9kJ•mol-1;
笫二步:;△H2=;
①填写第二步反应的热化学方程式,并根据反应历程图计算△H2的数值。
②该反应的最高能垒(活化能)为。
|
容器 |
反应物投入的量 |
平衡时 n(N2/mol) |
达到平衡所需时间/min |
平衡时能量变化/kJ |
|
甲 |
1molCO和1molN2O |
n1 |
t1 |
放热Q1 |
|
乙 |
2molCO和2molN2O |
n2 |
t2 |
放热Q2 |
|
丙 |
2molCO2和2molN2 |
n3 |
t3 |
吸热Q3 |
①Q1+ 358.6(填“>”“=”或“<”下同,t1t2;
②500℃条件下,乙和丙两容器,气体混合物中N2O的物质的量分数x(N2O)与反应时间t的关系如下表:
|
t/s |
0 |
20 |
40 |
60 |
80 |
120 |
|
|
乙 |
x(N2O) |
0.5 |
0.32 |
0.20 |
0.12 |
0.088 |
0.07 |
|
丙 |
x(N2O) |
0 |
0.030 |
0.048 |
0.059 |
0.065 |
0.07 |
根据上述实验结果,计算出乙容器中0~20s时间内的化学反应速率v(CO)=;该反应的平衡常数K数值为:;(保留3位有效数字)
③请推测并在图中画出甲容器中x(N2O)随时间变化的关系图象,标出恰好达到平衡时刻点的位置。



| 共价键 | C—O | H—O | N—H | C—N |
| 键能/k.J•mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=k.J•mol-1 。
②N2(g)+2O2(g) 2NO2(g)△H2=+68kJ•mol-1
③N2(g)+O2(g) 2NO(g) △H3=+183kJ•mol-1
则:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=kJ•mol-1。
CH3CH2CH=CH2(g) CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
|
化学键 |
C-C |
C=C |
C-H |
H-H |
|
键能/kJ·mol-1 |
348 |
612 |
412 |
436 |

①请解释工业生产控制温度在600℃的原因 。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=kPa·h-1;脱氢反应的平衡常数Kp=kPa(Kp为以分压表示的平衡常数,P分=P总×物质的量分数)。
A.氢气总产量减少 B.反应①的甲烷转化率升高
C.会产生副反应 D.对反应②的平衡无影响




①用H2表示的前2h的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
①该反应的△H0(填“>”或“<”)。
②曲线 表示的物质为(填化学式)。

图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
相关主要反应如下:
I. C(s) + H2O(g) CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g) CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g) CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s) CaCO3(s) + 2H2 (g)的△H =kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s) CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是。(填字母编号)
A. 适当的降低体系的温度
B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气
D. 增加CaO的量

2CO2(g)+6H2(g)=CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
|
键 |
H-H |
C=O |
C=C |
O-H |
C-H |
|
键能/kJ/mol |
436.0 |
745.0 |
615.0 |
462.8 |
413.4 |
则a=。


①图2中S代表的物理量是。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器体积不变,则平衡会(填“正向移动”“逆向移动”或“不移动”)。

①阳极区产生CO2的原因是(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因。
某温度下,2H2O(g) 2H2(g) +O2(g),该反应的平衡常数表达式为K=。
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1mol H2(g),热量变化是62 kJ,则该反应的热化学方程式为。

在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。

①向2 L恒温恒容密闭容器中加入一定量的CO和0.1mol H2O(g),在图中G点对应温度下,反应经5 min 达到平衡,则平均反应速率v(CO)=。
②图中B、E 两点对应的反应温度分别为TB和TE , 则TBTE (填“>”“ <”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G 三点对应的相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2和x mol H2 , 为使上述反应开始时向正反应方向进行,则x应满足的条件是。
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为。

②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为。
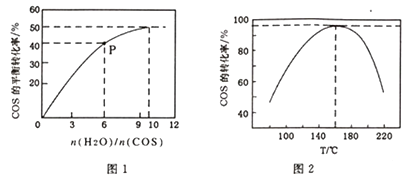
①该反应的最佳条件为:投料比[n(H2O)/n(COS)],温度
②P点对应的平衡常数为 。(保留小数点后2 位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是。
CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+H2O(g) CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H 3 ③
则反应①自发进行的条件是,△H3 =KJ·mol-1
某2L恒容密闭容器中,投入2 mol CH4和2 mol CO2 , 不同温度下平衡体系中CH4和CO的物质的量分数 /(y)%随温度变化如右图所示:

①T1温度下该反应的平衡常数是
②2c点CH4的物质的量分数为
③v逆:ab点(填“>”、“<”、“=”、“无法确定”),理由是。
