
已知:丁二酮肟可与Ni2+反应生成易溶于有机溶剂的配合物:Ni2++2C4H8N2ONi(C4H7N2O)2+2H+

已知:①1-丁醇微溶于水,易溶于乙醚;
②R-CHO+NaHSO3(饱和)→R-CH(OH)SO3Na↓。
下列说法错误的是

实验室中模拟“酸性歧化法”制备。下列说法正确的是
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | NaBr(aq)(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | NH4Cl(aq)(FeCl3) | NaOH(aq) | 过滤 |
| C | CO2(CO) | CuO粉末 | 通过灼热的CuO粉末 |
| D | CH3COOC2H5(CH3COOH) | C2H5OH、浓硫酸 | 加热蒸馏 |


室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | |||||
开始沉淀时的pH | 7.8 | 5.5 | 5.8 | 1.8 | 8.3 |
完全沉淀时的pH | 9.4 | 6.7 | 8.8 | 2.9 | 10.9 |
下列说法正确的是

已知:①的溶解度随温度升高而降低;
②常温下,几种难溶物质的溶度积数据如下:
物质 | |||||
下列说法错误的是
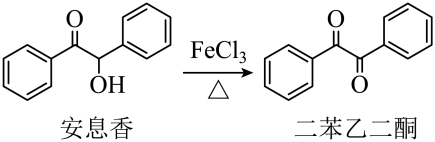
相关信息列表如下:
|
物质 |
性状 |
熔点/℃ |
沸点/℃ |
溶解性 |
|
安息香 |
白色固体 |
133 |
344 |
难溶于冷水 溶于热水、乙醇、乙酸 |
|
二苯乙二酮 |
淡黄色固体 |
95 |
347 |
不溶于水 溶于乙醇、苯、乙酸 |
|
冰乙酸 |
无色液体 |
17 |
118 |
与水、乙醇互溶 |
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入冰乙酸、
水及
, 边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入安息香,加热回流
。
③加入水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用的乙醇重结晶,干燥后得淡黄色结晶
。
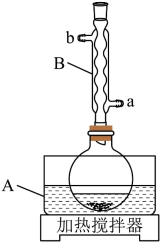
回答下列问题:
a.热水 b.乙酸 c.冷水 d.乙醇
a. b.
c.
d.
(已知:Ga3++4OH- [Ga(OH)4]- K′=
≈1.0×1034)

该晶体中B的配位数为,其晶胞参数为 , 则立方氮化硼晶体的密度为
。

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Co2+ |
开始沉淀的pH | 7.5 | 2.2 | 6.7 |
完全沉淀的pH | 9.5 | 3.0 | 8.7 |
②在pH为4~6时,Fe3+水解生成含Fe(OH)3·nFe3+·(n-x) 胶粒的胶体;
③金属钴与铁具有相似的化学性质;
④氧化性:Co3+>ClO-。
回答下列问题:


已知:①25℃时溶液中金属离子物质的量浓度c与溶液pH的关系如图所示:

②Sr (OH)2、 Ca (OH) 2在不同温度下的溶解度表
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
90 |
100 |
|
Ca(OH)2/g |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
0.07 |
|
Sr(OH)2/g |
0.91 |
1.77 |
3.95 |
8.42 |
20.20 |
44.50 |
91.20 |
回答下列问题:


该晶体中B的配位数为,其晶胞参数为 , 则立方氮化硼晶体的密度为
。

回答下列问题:

反应时,接受电子对的一方是;Co2+、Ni2+能发生上述转化而Zn2+不能,推测可能的原因为。

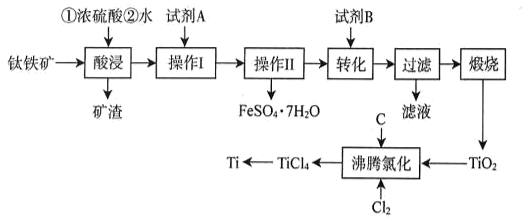
已知:①TiO2+易水解,只能存在于强酸性溶液中;高温下Ti易与N2 , H2反应。
②25℃时相关物质的Ksp见表:
物质 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | TiO(OH)2 |
Ksp | 1.0×10-16.3 | 1.0×10-38.6 | 1.0×10-11.6 | 1.0×10-29 |
回答下列问题:
①试剂B为(填标号)。
A.H2SO4 B.H2O2 C.Na2CO3 D.NH4Cl
②为沉钛完全[c(TiO2+)≤1.0×10-5mol•L-1]需要调节溶液的pH略大于。
物质 | TiCl4 | Cl2 | CO | CO2 |
分压MPa | 4.59×10-2 | 4.98×10-9 | 1.84×10-2 | 3.70×10-2 |
该温度下,TiO2与C、Cl2反应的总化学方程式为。
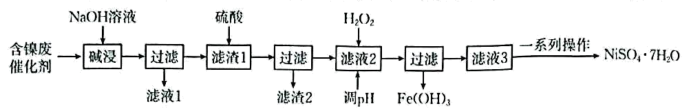
已知:①常温下,部分金属化合物的近似值如表所示:
化学式 | |||||
|
②金属活泼性:。
③。
回答下列问题:
A.锥形瓶中溶液颜色由橙黄色局部变为紫色后立即停止滴定
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
C.滴定前平视读数,滴定后仰视读数


I.取0.8400 g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250 mL容量瓶中后定容。
II.准确量取25.00 mL待测液于锥形瓶中,加入0.0200 mol·L-1KMnO4标准溶液25.00 mL,向锥形瓶中再加入25.00 mL 0.06 mol·L-1Fe2+溶液,加入磷酸后再用0.0200mol·L-1KMnO4滴定,消耗KMnO4溶液10.00 mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒的质量分数 (写出计算过程)。

已知化合物的溶解度(水)数据如下表:
物质 | ||||||||
49.7 | 59.0 | 62.5 | 66.7 | 70.0 | 78.3 | 88.7 | 94.9 | |
342 | 363 | 395 | 437 | 452 | 488 | 541 | 614 |
回答下列问题:
操作1应选择____(填字母序号)。
检验粗产品中含有
的操作方法是。
准确称取重结晶后的
晶体,溶于混酸中并定容至
。移取三份
溶液,加入指示剂,用
标准溶液(
)滴定至终点,半分钟内不恢复,平均消耗标准溶液体积为
(此时
不被氧化)。
计算晶体的纯度为
(含a、c的代数式,化到最简)。

已知:I.时,相关物质的
如下表:
物质 | |||||
II.时,
电离常数
III.离子浓度低于时即为沉淀完全
回答下列问题:
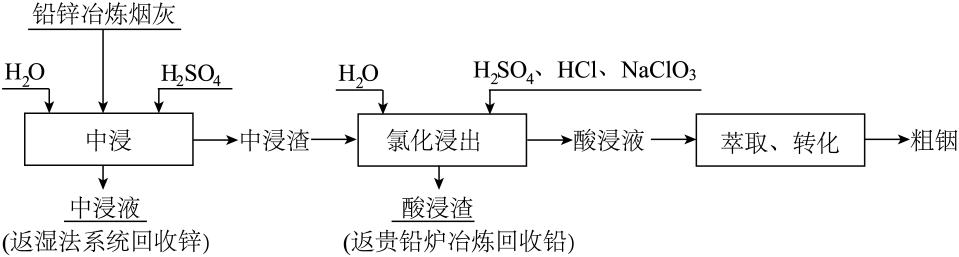
已知:①烟灰中钢主要以硫化铟、氧化铟以及和
形式存在,其中
和
的化学性质非常稳定,难以被硫酸溶解浸出。
②铅锌冶炼烟灰先经稀硫酸溶液预处理后得到中浸渣,主要成分如下:
|
成分 |
|
|
|
|
|
|
质量分数(%) |
0.72 |
3.01 |
60.48 |
8.92 |
1.16 |
③酸性条件下,温度过高,氯酸钠易分解释放出氯气。
回答下列问题:

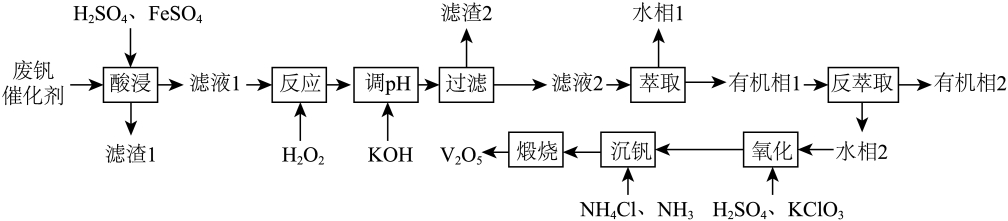
回答下列问题:
A.![]() B.
B. C.
C.
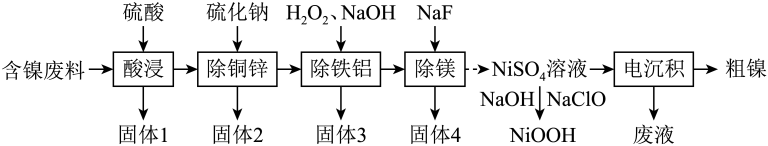
已知常温下部分难溶物的如表所示:
物质 | |||||||
请回答下列问题:

回答下列问题:

若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1 , 此时溶液的pH为5,则溶液中c()= mol·L-1 (保留2位有效数字)。
已知常温下:
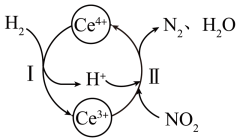
①该反应中的催化剂为(写离子符号);
②该转化过程中还原剂与氧化剂物质的量之比为。

请回答下列问题:
②滤渣成分的化学式是

①该装置中铜电极应连接直流电源的极。
②石墨电极的电极反应式为。
③当有0.1molCu2O生成时电路中转移mol电子。

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42- , 自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的pH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的pH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
