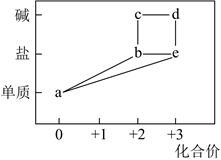
|
实验 |
操作与现象 |
|
① |
在 |
|
② |
在 再滴加 |
|
③ |
在 将上述混合液分成两份,一份滴加 另一份煮沸,产生红褐色沉淀。 |
依据上述实验现象,结论不合理的是( )
实验操作 | 现象 | 结论 | |
A | 将铜丝插入 FeCl3溶液中 | 铜丝溶解 | 铜的金属性大于铁 |
B | 向Zn-Fe-酸化的NaCl溶液形成的原电池的铁电极附近滴加K3[Fe(CN)6]溶液 | 铁表面有蓝色沉淀生成 | 锌不能作为保护铁的牺牲阳极 |
C | 25℃时测盐(MR)溶液的pH | pH=7 | 不能判断MOH和HR是否均为强电解质 |
D | 向苯酚浊液中滴加饱和Na2CO3溶液 | 浊液变澄清 | 苯酚的Ka大于碳酸的Ka1 |

已知:Fe(OH)3的;Fe(OH)2的
;Fe3+开始沉淀时的pH≈1.5;Fe2+开始沉淀时的pH≈6.3
下列说法错误的是
选项 | 生活应用或生产活动 | 化学知识 |
A | 用二氧化碳跨临界直接制冰 | 液态二氧化碳汽化时吸热 |
B | 用小苏打焙制糕点 |
|
C | 用 |
|
D | 丙三醇可用于配制化妆品 | 丙三醇与水形成氢键,有很强的保湿性 |

为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
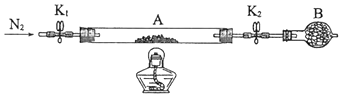
①仪器B的名称是.
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.
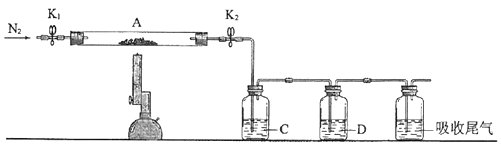
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为.
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式.

|
阳离子 |
u∞×108/(m2·s−1·V−1) |
阴离子 |
u∞×108/(m2·s−1·V−1) |
|
Li+ |
4.07 |
|
4.61 |
|
Na+ |
5.19 |
|
7.40 |
|
Ca2+ |
6.59 |
Cl− |
7.91 |
|
K+ |
7.62 |
|
8.27 |
(14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示:
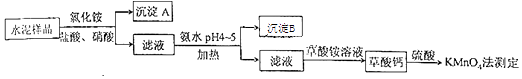
回答下列问题:

已知:相关离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如下:
金属离子 | Cu2+ | Fe2+ | Fe3+ | Ca2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
沉淀完全的uH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |


常温下,各种离子沉淀时的pH如下表:
离子 | |||
开始沉淀时的pH | 1.5 | 3.4 | 8.2 |
完全沉淀时的pH | 2.8 | 4.7 | 10.2 |

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中沉淀的pH范围如下表所示(25℃):
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 7.6 | 7.3 | 3.0 |
完全沉淀的pH | 3.2 | 9.6 | 9.3 | 5.2 |
③离子浓度≦10-5mol·L-1时,离子沉淀完全。

查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

II.“焙烧”过程中铁的氧化物未参与反应
III.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓)Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
IV.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:


回答下列问题:

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
Fe2+ | Fe3+ | Al3+ | |
开始沉淀 | 7.5 | 2.7 | 3.8 |
完全沉淀 | 9.5 | 3.7 | 4.7 |
酸浸时,所发生氧化还原反应的离子方程式为。
a.使Fe2+充分转化为碳酸亚铁
b.碳酸氢铵受热分解
c.促进Fe2+、CO的水解

实验:
由上面实验可以得出碳酸亚铁的相关性质是,写出碳酸亚铁变成红褐色固体所发生反应的化学方程式。


①80℃时,加入碳酸钠偏多时得到的黄钠铁矾中含有的杂质是。
②生成黄钠铁矾的离子反应方程式。
③由图在pH=2时,温度过高或过低,不易制得黄钠铁矾。试解释其原因。
①滴定终点的实验现象是。
②样品中铁的质量分数为。
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4 , 主要的生产流程如下:

①写出反应①的离子方程式。
②请写出生产流程中“转化”(反应③)的化学方程式。
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)Ksp(Na2FeO4)(填“>”“<”或“=”)。
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液。
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数的变化情况是。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,转化为。(填化学式)

已知:①Ni2++H2Y2-=[NiY]2-+2H+
②紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的现象是。
②如果紫脲酸胺滴入过多,终点延迟,则会导致。

|
装置编号 |
填装试剂 |
实验现象 |
实验结论 |
|
A |
FeSO4·7H2O |
绿色固体逐渐变为红色粉末 |
|
|
B |
① |
② |
分解产物中含有SO2 |
|
C |
BaCl2溶液 |
产生白色沉淀 |
③ |
|
D |
无水CuSO4粉末 |
白色固体逐渐变为蓝色 |
分解产物中含有水蒸气 |
|
E |
④ |
 回答下列问题:
回答下列问题:
①含铋物质发生反应的化学方程式为:
i.Bi2O3+3H2SO4+6NaCl=2BiCl3+3Na2SO4+3H2O
ii.Bi2S3+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4+3S
iii.。
②“滤渣2”的主要成分除S外还有。
|
金属离子 |
Fe2+ |
Fe3+ |
Zn2+ |
|
开始沉淀时pH |
7.0 |
1.9 |
6.2 |
|
完全沉淀时pH |
9.0 |
3.2 |
8.0 |
①结合上述信息分析,“水解”时加入适量Zn粉的目的是。
②“水解”后的“系列操作”为。
连接装置,检査装置气密性。将0.1mol(NH4)2SO4晶体置于玻璃仪器(填仪器名称)中,将6.0g洁净铁屑加入锥形瓶中。
②待大部分铁粉溶解后,打开K3、关闭K2 , 此时可以看到的现象为,原因是。
③关闭活塞K2、K3 , 采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、、用无水乙醇洗涤晶体。装置A中的反应,硫酸需过量,保持溶液的pH在1~2之间,其目的为。
④装置C的作用为,装置C存在的缺点是。
提出问题: 、Br2哪个氧化性更强?
供选用的试剂:a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。
|
选用试剂(填序号) |
实验现象 |
|
|
方案1 |
|
|
|
方案2 |
|
|
实验后的思考:根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是。
某实验室用含少量铁的废铜渣为原料生产胆矾的流程如下:
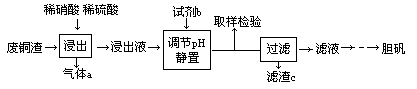
已知: 在pH为2.7时开始沉淀,到3.7时沉淀完全;
在pH为4.7时开始沉淀。

①元素a位于元素周期表五个区中的区,基态原子a核外电子占据最高能层电子的电子云轮廓图形状为。
②据所学知识,预测与元素a同主族短周期元素b的I1在上图中相应位置上用圆点(•)画出,并标注该元素的元素符号。
③基态原子b的价层电子排布图:。
