反应I:CH3CH2OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H1=+173.5kJ·mol-1
反应II:CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ·mol-1
则1molCH3CH2OH(g)与H2O(g)作用生成CO(g)和H2(g)反应的△H为( )


S(s)+O2(g)=SO2(g) △H2
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H3
下列表述正确的是( )



 所需的活化能小于制备
所需的活化能小于制备  C . 产生一氯取代物的过程中有极性键和非极性键的断裂和形成
D . 反应过程中,有可能会产生
C . 产生一氯取代物的过程中有极性键和非极性键的断裂和形成
D . 反应过程中,有可能会产生  和
和  等副产物
等副产物

反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)△H2
下列说法正确的是( )
Ⅰ.
Ⅱ.
使和
按物质的量1∶1进入反应器,定时测定反应器尾端出来的混合气体中各产物的量,得到单程收率(
)与温度的关系如图所示。下列说法正确的是( )
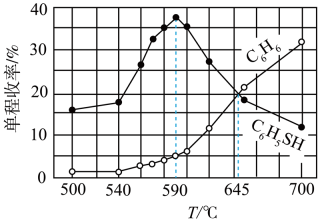

已知:①水醇比为2:1时,各点均已达到平衡状态
②不同的水醇比会影响催化剂的催化效果
下列说法正确的是( )
| 容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
| CH4 | H2O | CO | H2 | ||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
| Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |

下列说法错误的是( )

①
②
③
氢化过程中所需的高纯度 可用惰性电极电解
溶液制备,写出产生
的电极名称(填“阳极”或“阴极”),该电极反应方程式为。

a.B点: b.
:A点
点 c.反应适宜温度:
℃
CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2 , 在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是。

电池的负极反应式:。
电池的正极反应式:6O2+6e−=6O2−
6CO2+6O2−=3C2O42−
反应过程中O2的作用是。
该电池的总反应式:。
①通过以上数据计算当I2和 H2反应生成2 mol H—I时会放出9kJ的能量;若将1 mol I2和1 mol H2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25 ℃,101 kPa)远小于上述计算值,你认为最可能的原因是。
①一定温度下,向2L恒容密闭容器中充入1.6 mol CH4和2.4 mol H2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图所示。0~2 min内的平均反应速率υ(H2)= mol·L-1·min-1 , 平衡时CH4的转化率为。[转化率=×100%]

②若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外, 还可以采取的措施有(任写一条)。
③下列能说明上述反应达到平衡状态的是(填代号)。
a υ逆(CH4)=3υ正(H2)
b 恒温恒容时,容器内混合气体的密度保持不变
c CH4(g)、H2O(g)的浓度保持不变
d CH4(g)、H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1:3
e 断开3 mol H-H键的同时断开2 mol O-H键

反应在(填“高温”或“低温”)下可自发进行;已知CH4的燃烧热ΔH为-890.3 kJ/mol,则表示CH4燃烧热的热化学方程式为。

①研究发现,在800~870℃温度区间内,随温度升高,H2S在平衡时反应混合物中含量迅速下降,而CS2的含量几乎为0,其原因可能是;
②研究发现,当温度大于900℃时,平衡混合物中非常接近4。则N点对应温度下,CH4的平衡转化率为;保持其他条件不变,若起始时不通入N2进行稀释,则CH4的平衡转化率会(填“降低”“升高”或“无影响”)
①已知25℃,H2CO3、H2S的电离常数Ka如下表所示:
|
|
|
|
|
|
|
|
|
|
|
|
写出Na2CO3溶液吸收足量H2S气体的离子方程式。
②Na2S2O3在酸性较强环境下不能稳定存在,其原因为(用离子方程式解释)。
则
(用含a、b式子表示)。

M处是外接直流电源的极(填“正”或“负”);离子交换膜应选择(填“阴”或“阳”)离子交换膜;当外电路转移0.1mol电子时,理论上Pt(B)电极区电解质溶液质量减少g。
第一步:NO在碱性环境中被氧化为 , 反应为:
;
第二步:继续被氧化为
, 反应为:
。
①溶液吸收NO的过程中,适当增加压强,对NO的脱除率的影响是(填“提高”“无影响”或“降低”)。
②在50℃时,将NO匀速通过足量浓度为
碱性溶液,3min后,测得溶液中
浓度为
。则该时间段内平均反应速率
(反应前后溶液的体积变化忽略不计)。

途径I:C(s)+O2(g)=CO2(g) △H1<0
途径II:先制成水煤气C(s)+H2O(g)=CO(g)+H2(g) △H2>0
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g) △H3<0
2H2(g)+O2(g)=2H2O(g) △H4<0
则途径I放出的热量(填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是。
①已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g) △H,表中所列为常见化学键的键能数据:
化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
则该反应的△H=kJ•mol-1。
②甲醇(CH3OH)也可由天然气来合成,已知:①2CH4(g)+O2(g)=2CO(g)+4H2(l) △H=-71kJ•mol-1 , ②CO(g)+2H2(g)=CH3OH(l) △H=-90.5kJ•mol-1 , ③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1 , 则甲醇的燃烧热为。若CO的燃烧热为282.5kJ•mol-1 , 则H2的燃烧热为。
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ•mol-1
则TiO2(s)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)的△H=。
化学键 | O=O | H—H | O—H |
键能E/(kJ·mol-1) | a | b | c |
则氢气燃烧热的△H=kJ/mol(用含a、b、c代数式表示)
①反应平衡常数K=。(结果保留2位有效数字)
②保持K不变,提高CO平衡转化率措施有:。(任意一条)
③由T1℃时上述实验数据计算得到v正~x(CO)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为。(填字母)

④研究表明,CO催化变换反应的速率方程为:v=k[x(CO)•x(H2O)-],式中,x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,KP为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的KP(填“增大”或“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是。

利用电解原理,将氨转化为高纯氢气,其装置如图所示。阳极的电极反应式为。


该工艺合成氨的反应方程式为。
将氨催化氧化后,生成NO2的总反应为:2NO(g)+O2(g)2NO2(g) ΔH=-57.1kJ•mol-1 , 反应分两步:
2NO(g)(NO)2(g) ΔH1<0 快反应,瞬间平衡
(NO)2(g)+O2(g)2NO2(g) ΔH2<0慢反应
当改变压强、温度时,NO转化率随时间变化如表所示。
压强/(×105Pa) | 温度/℃ | NO转化所需时间/s | ||
50% | 90% | 98% | ||
1 | 30 | 12.4 | 248 | 2830 |
90 | 25.3 | 508 | 5760 | |
8 | 30 | 0.19 | 3.88 | 36.6 |
90 | 0.59 | 7.86 | 74 | |
已知:反应生成NO2的速率方程v=k•K•p2(NO)•p(O2)。k是速率常数,K是快反应的平衡常数。
①增大压强,总反应速率(填“变快”或“变慢”,下同)。
②升高温度,总反应速率,原因是。

①代表NO2的曲线是。(填“a”或“b”)。
②假设平衡时体系的总压为P0 , 则A点温度下的平衡常数Kp=(含P0的表达式),NO2的平衡转化率=。
已知:H2在催化剂Rh表面还原NO的部分反应机理如下表所示。
|
序号 |
基元反应 |
活化能Ea/( kJ∙mol-1) |
|
① |
|
12.6 |
|
② |
|
97.5 |
|
③ |
|
83.7 |
|
④ |
|
33.5 |
|
⑤ |
|
77.8 |
基元反应的焓变△H=。
已知:的速率方程为
, k为速率常数,只与温度有关。
①画出未达平衡时随时间t的变化关系趋势图。

②为提高该反应的化学反应速率,可采取的措施是(填字母序号)。
A.升温 B.恒压时,再充入N2 C.恒容时,再充入CO D.恒压时,再充入N2O
|
温度K |
时间t/min |
0 |
10 |
20 |
40 |
50 |
|
T1 |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
0.15 |
0.15 |
|
T2 |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
①T1温度下,0~20min内,NO2降解速率为。
②T1 T2 (填“>”“<”或“=”),该反应为反应(填“吸热”或“放热”)。
③设为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以
。已知T2温度下,反应达平衡时,CH4的分压为akPa。则T2温度时,该反应的相对压力平衡常数
=。

图中的两步反应属于放热反应的。(用
、
、
、
表示,下同)
已知:①
②
③
请写出分解生成
与
气体的热化学方程式:。
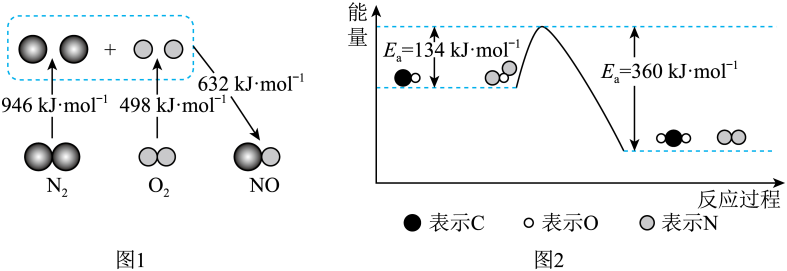
①图2中反应是(填“放热”或“吸热”)反应,该反应的活化能为,该反应的△H=。
②加入Pt2O+作为该反应的催化剂,则Ea(填“增大”“减小”或“不变”,下同),△H。
①CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-a kJ/mol;
②CO2(g)+NaOH(aq)=NaHCO3(aq) △H =-bkJ/mol。
反应CO2(g)+Na2CO3(aq)+H2O(l)=2NaHCO3(aq)的△H=kJ/mol (用含a、b的代数式表示)。
化学键 | N≡N | F-F | N-F |
键能/kJ/mol | 946.0 | 157.0 | 283.0 |
①关于反应 , △H=。
②NF3对半导体硅进行蚀刻时,在蚀刻物表面不留任何残留物,试写出蚀刻反应方程式。