
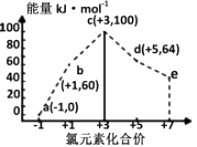
Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )

①CO(g)+1/2O2(g)=CO2(g) ΔH1=a kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH2=bkJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=ckJ/mol
下列说法确的是( )

下列说法正确的是( )
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH1=-252.9 kJ·mol-1
②2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6 kJ·mol-1
下列说法错误的是


两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是.
图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率(填“是”或“不是”)对应温度下的平衡转化率,判断理由是;高于460℃时,丙烯腈产率降低的可能原因是(双选,填标号).

A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
物质 | CO2(g) | CO(g) | H2O(g) |
| -394 | -111 | -242 |
①从开始到平衡,反应1的v(H2)=mol·L-1·min-1。
②反应4中甲醇的转化率为,反应1的平衡常数Kc=。

①燃油汽车尾气仍含有较多 、
的可能原因是。
②写出一项有效提升尾气达到排放标准的措施:。
反应Ⅰ:
反应Ⅱ:…………
反应Ⅲ:
①出反应Ⅱ 和
生成
和
的热化学方程式:。
②在不同温度下, 负载型金属催化作用下,反应Ⅲ进行结果如下图所示,其中
选择性=
。

i.反应Ⅲ的平衡常数的表达式为。
ii.在测定温度内,该催化剂对 甲烷化反应的最适宜温度为,理由:。
iii. 时,在上述实验条件下向某装有该催化剂的密闭容器中通入
和
,充分反应后生成
的物质的量为。
在25℃时,1.00gN2H4(l)与足量N2O4(1)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。写出该反应的热化学方程式。
II.NO2是氮的常见氧化物,能自发发生如下反应:2NO2(g)⇌N2O4(g) =-57.20kJ/mol
a.减小NO2的浓度 b.降低温度 c.增大压强 d.升高温度
III.Na2CO3俗称纯碱,是生活中的常用物质。某化学兴趣小组的同学对Na2CO3溶液显碱性的原因进行了探究,设计了如下实验方案进行操作并记录实验现象。
|
实验操作 |
实验现象 |
|
取少量Na2CO3固体,加入无水酒精,充分振荡、静置 |
溶液为无色 |
|
取上层清液于试管中,滴加酚酞试剂 |
溶液为无色 |
|
在试管中继续加入少量水 |
溶液变为红色 |
|
向该红色溶液中滴加足量BaCl2溶液(中性) |
红色褪去 |
②从形成盐的酸和碱的强弱角度看,Na2CO3属于盐。
③为了使Na2CO3溶液中 的比值变小,可适量加入(或通入)的物质是。
a.CO2气体 b.KOH固体 c.HCl气体 d.Na2CO3固体
I2O5(s)+5CO(g) 5CO2(g)+I2(s) △H2=-1377.2 kJ/mol Ⅱ
则表示CO燃烧热的热化学方程式为。

①该温度下反应的平衡常数K=(可用分数表示)。
②图2是CO的平衡转化率随CO2的移出率[ ×100%]关系。则图中a=,b=。

③由M点变为N点耗时5min,则该段时间内的平均反应速率v(CO)=。
则 的
。

① 时
内生成甲醛的平均反应速率是。
②若 时
恰好平衡,容器的初始压强为
,甲醇的转化率为
,甲醛的选择性为
,主要反应
的压强平衡常数
为。
③ 以后,甲醛的选择性下降的可能原因为。
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-23.5kJ∙mol-1
用二氧化碳和氢气反应制取二甲醚的热化学方程式为。
①下列有关叙述正确的是(填字母序号)。
a.容器内气体密度不再发生改变,说明反应达化学平衡状态
b.使用合适的催化剂可以提高单位时间内CH3OCH3的产率
c.反应达化学平衡后,向容器内通入少量氦气,则平衡向正反应方向移动
d.反应达平衡状态后向容器内再通入1molCO2和3molH2 , 重新达平衡后CH3OCH3体积分数增大
②升高温度,二甲醚的平衡产率(填“增大”、“减小”或“不变”),原因是。
③CO2与H2混合气体以一定的比例和一定流速分别通过填充有催化剂I和催化剂II的反应器,CO2转化率与温度的关系如图。a点的CO2转化率(填“是”或“不是”)平衡转化率,在催化剂I作用下,温度高于T1时,CO2转化率下降的原因可能是


则T1T2(填“>”、“<”或“=”,下同),M点的正反应速率N点的逆反应速率。

①阳极的电极反应式为。
②若以铅蓄电池为电源,A应与铅蓄电池的(填“Pb”或“PbO2”)相连。
CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41kJ/mol
CO(g)+2H2(g)CH3OH(g) ΔH=-90kJ/mol
①写出CO2(g)合成CH3OH(g) 总反应的热化学方程式:
②能说明反应CO2(g)合成CH3OH(g) 总反应已达平衡状态的是(填字母)。
A.CO2、H2、CH3OH分子数之比为1:3:1的状态
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的密度不再变化
E.单位时间内,每断裂2个C=O键,同时断裂3个O-H键
③在一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2 , 发生CO2合成CH3OH的总反应,测得10min达到平衡时氢气的平均速率为0.12mol/(L·min),则该反应的平衡常数为(保留一位小数)。该反应中v正=k正•c(CO2)•c3(H2),v逆=k逆•c(CH3OH)•c(H2O),其中k正、k逆为速率常数,仅与温度有关,则当反应过程中CO2的物质的量为0.5mol时,v正:v逆=。
2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ∆H<0。
①写出实验室制备乙烯的化学方程式:
②达到平衡后,欲增加乙烯的产率,并提高反应的速率,可采取的措施(写出其中符合条件的一种)
③CO2催化加氢合成乙烯往往伴随着副反应,生成低碳烃,在一定的温度和压强下,为提高乙烯选择性,应当
④如图所示,关闭活塞,向甲乙两个密闭容器分别充入1molCO2和3molH2 , 发生反应CO2催化加氢生成乙烯,起始温度体积相同(T1℃、4L密闭容器),达到平衡时,乙的容器容积为2.8L,则平衡时甲容器中CO2的物质的量0.2mol(填“大于、小于、等于、无法确定”)

温度/℃ | 25 | 400 | 450 |
K | 5 ×108 | 0.507 | 0.152 |
从平衡角度考虑,工业合成氨应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因。

已知:第一步:*H++e- =*H(快)(吸附在催化剂表面的物质用*表示);
第二步:N2+2*H =中间体(吸附在催化剂表面)(慢);
第三步:(快)(写出第三步的方程式)。
其中,第二步为决速步,原因是(从反应物分子结构角度)。

根据图示,b点v正v逆(填“>”、“< ”或“=”),温度高于T4后曲线重合为ac的合理解释是;c点时,正、逆反应瞬时速率方程:v正(H2)= k1·c3(H2)·c(N2)和v逆(NH3)= k2·c2(NH3),此条件下反应的平衡常数K= (用含k1、k2的代数式表示)。

若q=10时,M点的N2的分压=MPa。此时该反应的压强平衡常数Kp=(MPa)-2(保留三位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
反应I:
反应II:
②若反应II逆反应活化能Ea(逆)为120 , 则该反应的Ea(正)活化能为
。

下列说法正确的是。
A.在反应过程中有极性键的断裂
B.本历程共分为5步反应进行
C.本历程的决速步骤的反应为:
D.加入催化剂M可以提高甲醇的平衡产率
②在催化剂M表面进行反应I,当起始量时,在不同条件下达到平衡,体系中CO2的转化率为α(CO2),在T=400℃下α(CO2)随压强变化关系和在p=60MPa下α(CO2)随温度变化关系如下图所示。其中代表在T=400℃下α(CO2)随压强变化关系的是(填“a线”或“b线”);a、b两线的交点E对应的平衡常数(填“相同”或“不同”)。当α(CO2)为80%时,反应条件可能是。

时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
压强/MPa | 120 | 105 | 95 | 90 | 88 | 88 |
(已知:CH3OH选择性=)
请计算反应开始至40min的平均反应速率v(CH3OH)=MPa/min;此时CH3OH的选择性为80%,则反应I的压强平衡常数Kp=(只列计算式,压强平衡常数:用平衡分压代替平衡浓度,分压=总压
气体物质的量分数)。


资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | -69 | -25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | — | 微溶 | 难溶 | |
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式。
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H0(填“>”“<”或“=”),判断依据。

①CO2甲烷化反应:CO2(g) +4H2(g)CH4(g) +2H2O(g)
H=-165 kJ·mol-1
②逆水煤气变换反应:CO2(g) + H2(g)CO(g) + H2O(g)
H=+41.1 kJ·mol-1



①设备②中发生主要反应的热化学方程式:。
②设备②中生成的难与
大量转化为
的原因是。

已知:的选择性
(生成
消耗的
的物质的量
消耗
的总物质的量)
①分析上述实验结果,下列说法正确的是。
A.的加入,降低了催化剂的活化温度
B.含量越大,催化剂的活性越好
C.运用该技术消除废气中的最佳条件为:
、
D.一定温度范围,的加入使得生成副产物反应活化能降低更为显著
②某实验条件下,维持反应系统压强为 , 原料气中
、O2、载气的物质的量分别为
、
;测得
的转化率和
的选择性均为80%,
氧化的副产物仅为
。反应
用气体分压表示的平衡常数为 (代入数据,不要求计算结果;组分分压
总压
组分物质的量分数)
I.CO2(g)+H2(g)→CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
II.2CO(g)+4H2(g)→C2H4(g)+2H2O(g) ΔH=+210.5kJ·mol-1
CO2加氢合成乙烯的热化学方程式为。
I.CO2(g)+3H2(g)→CH3OH(g)+H2O(g) ΔH=-48.5kJ·mol-1
II.2CO2(g)+5H2(g)→C2H2(g)+4H2O(g) ΔH=+37.1kJ·mol-1
在压强为P,CO2、H2的起始投料为1:3的条件下,发生反应I、II。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度的变化如图所示。

已知:CH3OH的选择性=
①有利于提高CH3OH的选择性的措施有(填序号)。
A.适当降温
B.适当升温
C.选择合适的催化剂
②温度高于350℃时,体系中发生的反应以 (填“I”或“II”)为主,并说明理由。
③其中表示平衡时CH3OH的选择性的曲线是 (填“a”或“b”)。
④400℃时,在该压强及投料比的条件下,利用图示所给数据计算H2的转化率为 (保留三位有效数字)。

①阴极反应为。
②阳极产生的气体是(写化学式)。

572 | |||
K |

写出电极B的电极反应式:。