


|
|
|
|
A.用做SO2喷泉实验 | B.探究压强对平衡的影响 | C.探究生铁在不同条件下的电化学腐蚀 | D.验证Cu与浓硝酸反应的热量变化 |


选项 | 劳动项目 | 化学知识 |
A | 用明矾处理含有悬浮微粒的水 |
|
B | 撒生石灰改良酸性土壤 | 生石灰能与酸性物质反应 |
C | 将炒菜的铁锅洗净后擦干 | 电化学腐蚀需要电解质 |
D | 用热的纯碱溶液去油污效果比较好 | 升高温度促进 |

编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/ | 醋酸/ |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 | 2.0 |
② | 醋酸浓度的影响 | 0.5 | a | 36.0 | 2.0 |
③ | M | 0.2 | 2.0 | 90.0 | 2.0 |

|
A |
B |
C |
D |
|
|
|
|
|
|
A.除去CO2中的水蒸气 |
B.进行喷泉实验 |
C.探究CH4与Cl2的反应 |
D.用铁氯化钾溶液验证牺牲阳极法保护铁 |

| A | B | C | D |
| | | | |
| 橡皮管能减小气体体积测量的误差 | 分离碘和四氯化碳的混合液 | 浓硫酸与萤石(主要成分为CaF2)加热制备HF | 防止铁管道被腐蚀 |
 C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中
C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 实验序号 | 实验装置 | 实验方案 | 实验现象 |
实验一 |
| 将 | |
将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。 | 铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀。 |
①请解释铜丝区域溶液变红的原因是。
②写出生成蓝色沉淀的离子方程式。
实验序号 | 实验方案 | 实验现象 |
实验二 | 取 | 滴入 |
根据实验二的现象,推测可能具有“填氧化性或还原性”。
实验序号 | 实验装置 | 实验方案 | 实验现象 |
实验三 |
| 取 | 溶液无明显变化 |
继续向试管中加入少许 | 一段时间后,铁片表面产生大量的蓝 |
根据实验现象推出实验三的结论是:在溶液中情况下,。
①补全实验方案2中的空格部分
|
实验序号 |
实验装置 |
实验方案 |
实验现象 |
|
实验四 |
|
1.按图连接好装置,准确读取电流表读数。 |
电流表指针偏转,读数为I |
|
2.取于试管中,加入溶液,振荡。 |
产生蓝色沉淀。 |
②思考:若电极X为时,电流表读数为
, 推测电极X为
时电流表读数的范围是。
实验步骤如下:
步骤1:将铁粉放置于0.002
溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。

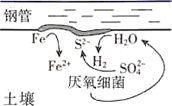
第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为。
①选取b点进行分析,经检验溶液中含有 , 写出Fe被腐蚀的总反应。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点被氧化的离子方程式。
③依据b点发生的反应,分析第二阶段pH上升的原因是。
在铁表面镀锌可有效防止铁被腐蚀
已知:放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的相连。
②向电解液中加入NaCN溶液,将
转化为
, 电解得到的镀层更加致密、细腻,原因是。
①滴定终点的现象是。
②废水中的含量是
(填计算式)。
实验ⅰ.向 溶液中滴加5滴
溶液,较快产生无色无味气体。
实验ⅱ.向 溶液中滴加5滴
溶液,无气体产生。
由此推断 对
分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b.
。实验ⅱ的目的是:。
常温下,不同浓度的过氧化氢分解率与pH的关系如图1所示。

已知: ,
①一定条件下,相同时间内 分解率随溶液
增大而增大的原因是:。
②相同 下,过氧化氢浓度越大分解速率越快,但是相同时间内
分解率反而降低,分析其原因。
①酸性条件下 腐蚀金属铜的离子方程式为。
②图2是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因。


Cu2(OH)3Cl属于(填“无害锈”和“有害锈”),请解释原因。

①过程I的正极反应物是。
②过程I负极的电极反应式是。
i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl- , 能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”

①Zn电极为电池的(填“正极”或“负极”)。
②写出电极反应式:Zn电极,Cu电极。
③盐桥中向CuSO4溶液中迁移的离子是(填离子符号)。

①图1中被腐蚀的金属为(填化学式);图2中金属腐蚀类型属于(填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是(填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为。
方法一:在高温下,通入水蒸气将煤样中无机盐转化为HCl,再滴定氯离子。
方法二:取a g煤样,处理后得到含氯离子的样品溶液,加入溶液,以
作指示剂,用
溶液滴定过量的
溶液,共消耗KSCN溶液
。
已知:能与KSCN反应生成AgSCN沉淀。
①结合化学用语,从化学平衡的角度解释方法一中无机盐中生成HCl的原因。
②方法二中,滴定终点的现象为。
③利用方法二,测得煤样中氯元素的质量分数为。
i.配制固定组分的铬酸银()浑浊液;
ii.将待测海砂样品与i中浑浊液混合,溶液的颜色会随着氯离子含量的变化而变化。
氯离子含量x | |||
ii中现象 | 沉淀仍然为砖红色 | 砖红色沉淀部分变为白色,溶液逐渐转变为黄色 | 砖红色沉淀完全变为白色,溶液完全转变为黄色 |
已知:;
;
溶液为黄色,
固体为砖红色。
①时,沉淀仍然为砖红色的原因是。
②写出砖红色沉淀变为白色的离子方程式。

①石墨烯是极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.
ⅱ.。
③协同转化总反应的化学方程式为,
在其中所起的作用是。
④工作时,石墨烯电极区的
基本保持不变,结合化学用语解释原因。
城市 | 年均温度℃ | 年均湿度% |
| 大气 | 腐蚀速率( |
A | 17.0 | 76 | 61 | 29 | 58 |
B | 12.3 | 72 | 54 | 420 | 79 |
①研究人员认为,A、B两城市中碳钢同时发生吸氧腐蚀和析氢腐蚀。碳钢发生析氢腐蚀时,正极的电极反应式为。
②结合化学用语解释A、B两城市中碳钢能发生析氢腐蚀的原因:。
③用电化学原理分析B城市碳钢腐蚀速率高于A城市的主要原因:。
A.制汽轮机叶片 B.制包装材料 C.制人造骨骼 D.制柴油机
现用四氯化硅和氮气在氢气气氛的保护下,加强热发生反应,可获得较高纯度的氮化硅,同时生成一种酸,反应的化学方程式为。

请分别写出A、B两种铁制品的名称及腐蚀时负极的电极反应式:
A:,负极:。
B:,负极:。

用于合成聚苯板基础材料的有机小分子(单体)是(填结构简式),该合成反应的反应类型为。

①容器内压强先增大后减小,除温度影响外的原因是。
②反应过程中,混合液里先期生成的会被氧化生成
, 反应的离子方程式为。
③后
略下降,原因是。
①在铁表面镀锌可有效防止铁被腐蚀。
已知:镀层金属析出缓慢、平稳时,镀层致密、细腻;溶液中与
可发生反应:
。以通入一定量
的
溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是。
②镀锌废液的回收。镀锌废液中含有等阳离子。请设计利用该电镀废液回收
溶液的实验方案:。(实验中可选用试剂:
、
溶液、
氨水)