
实验 | 实验操作和现象 |
1 | 向 |
2 | 向 |
3 | 向 |








名称 | Ka1 | Ka2 | Ka3 |
磷酸 | 5.2×10-3 | 8×10-8 | 6×10-13 |
则常温下KH2PO4水溶液显(填“酸”“碱”或“中”)性,下列有关KH2PO4水溶液中的微粒关系正确的是(填标号)。
A.c(H2PO)>c(H3PO4)>c(HPO
)>c(PO
)
B.c(K+)+c(H+)=c(H2PO)+2c(HPO
)+3c(PO
)
C.c(K+)=c(H3PO4)+c(H2PO)+c(HPO
)+c(PO
)

a.c(H+) b.c(OH-) c. d.

①R、Q两点溶液pH关系是:RQ(填“>”、“=”或“<”),R、Q两点对应溶液中水的电离程度的关系:RQ(填“>”、“=”或“<”)。
②滴定过程中,若 , 则此时溶液中
。
③N点离子浓度由大到小的顺序为。
物质 | CH3COOH | NH3∙H2O | HCN | HClO | H2CO3 | H2SO3 |
电离常数(Ka) | 1.7×10−5 | 1.7×10−5 | 4.9×10−10 | 3×10−8 | Ka1=4.3×10−7 Ka2=5.6×10−11 | Ka1=1.5×10−2 Ka2=1.0×10−7 |
常温下,NaCN溶液呈(填“酸”、“碱”或“中”)性,其原因是(用离子方程式表示)。
向某含镉废水中加入Na2S,当S2−浓度达到8.0×10−8 mol∙L−1时,废水中Cd2+的浓度为mol∙L−1 , 此时是否符合生活饮用水卫生标准?(填“是”或“否”)。

A.饱和溶液 B.碱石灰 C.饱和
溶液 D.酸性高锰酸钾溶液
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
已知:①25℃时, ,
②当溶液中某种离子的浓度等于或小于时,可认为已完全沉淀。
 , 镓元素在元素周期表中的位置是。
, 镓元素在元素周期表中的位置是。
a.镓的金属性比铝的强 b.砷化镓具有半导体性质
c.As与H2在低温时可剧烈化合为AsH3 d.酸性:H2SO4>H3PO4>H3AsO4
亚砷酸(H3AsO3)可以用于治疗白血病。亚砷酸溶液中各种微粒物质的量分数与溶液pH关系如图所示。

+□ (在“□”里填入系数在“ ”上填入微粒符号),加入
可以提高
去除率,原因是。
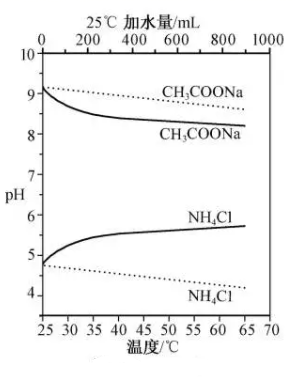
①显碱性,结合化学用语,用化学平衡原理解释其原因:。
②显酸性。用氨水吸收
, 当吸收液显中性时溶液中离子浓度关系正确的是(填字母)。
a.
b.
c.

①在阴极放电的物质是。
②在阳极生成的电极反应式是。