
 B . 乙醛空间填充模型:
B . 乙醛空间填充模型: C . 反式聚异戊二烯结构简式:
C . 反式聚异戊二烯结构简式: D . 基态铬原子的价层电子排布式:
D . 基态铬原子的价层电子排布式: B . 用惰性电极电解饱和食盐水时,阳极的电极反应式为:
B . 用惰性电极电解饱和食盐水时,阳极的电极反应式为: , 中心离子的配位数为4
, 中心离子的配位数为4
 C . As的原子结构示意图:
C . As的原子结构示意图:  D . HCl的形成过程:
D . HCl的形成过程: 

A.sp B.sp2 C.sp3 D.sp3d
H2S | S | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
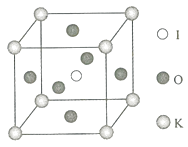
在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于位置,O处于位置.




A. ![]() B.
B. ![]() C.
C. ![]()
物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
沸点(℃) | 46 | 118 |

 , S原子的杂化方式为,S元素的化合价为。
, S原子的杂化方式为,S元素的化合价为。


回答下列问题:
A.[Ar]![]() B.[Ar]
B.[Ar]![]()
C.[Ar]![]() D.[Ar]
D.[Ar]![]()



|
元素 |
Fe |
Cu |
|
第一电离能 | 759 | 756 |
| 第二电离能 | 1561 | 1958 |
大于
的主要原因是。
A. B.
C.
D.


回答下列问题:


图甲为一种无限长单链结构的多硅酸根一部分,其中Si原子的杂化方式为,该多硅酸根的最简式为。

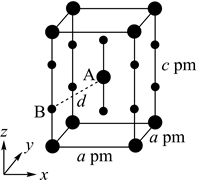
①晶胞中离Ti最近的O有个;由Ti原子和O原子构成的四面体空隙与二者构成的八面体空隙之比为。
②已知该晶体的密度为 ,则晶胞中Ti与O的最近距离是nm(用含
、
的代数式表示)。
请回答下列问题:

①氯元素基态原子的价电子排布式为;按照核外电子排布对元素周期表分区,溴元素位于区;基态硅原子中有种运动状态不同的电子。
②Br、I的第一电离能的大小关系:I1(Br)I1(I)(填“大于”“小于”或“等于”)。
③常温下,(CH3)3SiI中Si—I键比(CH3)3SiCl中Si—Cl键易断裂的原因是。

①1个有机物A分子中采取sp2杂化的碳原子有个。
②有机物B的沸点低于对羟基苯甲醛(![]() )的沸点,其原因是。
)的沸点,其原因是。
③CH3CN中σ键与π键的个数比为。

①该钛硅碳新型材料的化学式为。
②已知该新型材料的密度为4.51g•cm-3 , 且a、b的长度均为307pm,阿伏加德罗常数的值用NA表示,则c的长度为pm (列出计算式)。
A.泡利原理 B.洪特规则 C.能量最低原理
A.π键 B.σ键 C.配位键 D.极性键

 (金刚石晶体)
(金刚石晶体) (石墨烯晶体)
(石墨烯晶体)
①在石墨烯晶体中,每个六元环占有个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接个六元环。
③写出金刚石的硬度大于晶体硅的原因:。




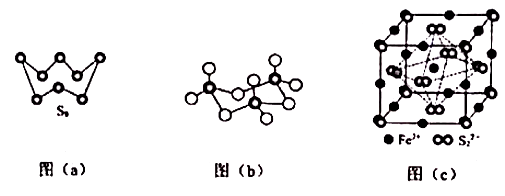
①该晶体的化学式为。
②该晶体中,每个氯原子周围与它最近且等距离的氯原子有个。
序号 | 实验步骤 | 实验现象或结论 |
ⅰ | 向 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为 |
ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
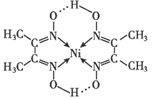
①深蓝色的配离子的结构简式:。
②晶体中
的中心原子杂化轨道类型为:。
③加入乙醇有晶体析出的原因:。
④该实验条件下,与
的结合能力(填“大于”“小于”或“等于”)
与
的结合能力。
⑤能与
形成
, 而
不能,其原因是。