
| 气体 | 试剂 | 制备装置 | 收集方法 | |
| A | O2 | KMnO4 | a | d |
| B | H2 | Zn+稀H2SO4 | b | e |
| C | NO | Cu+稀HNO3 | b | c |
| D | CO2 | CaCO3+稀H2SO4 | b | c |

试剂X | 试剂Y | 试剂Z | 制备气体 | |
A | 稀盐酸 | 大理石 | 饱和碳酸氢钠溶液 | CO2 |
B | 浓盐酸 | 二氧化锰 | 饱和食盐水 | Cl2 |
C | 浓氨水 | 生石灰 | 浓硫酸 | NH3 |
D | 稀硝酸 | 铜片 | 水 | NO |


选项 | 试剂a | 试剂b | 试剂c |
A | 浓盐酸 | KClO3 | AgNO3溶液 |
B | 浓H2SO4 | 少量蔗糖 | AlCl3溶液 |
C | 浓氨水 | CaO | MgCl2溶液 |
D | 稀HCl | CaCO3粉末 | 饱和Na2CO3溶液 |


N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
下列有关模拟侯氏制碱法的实验原理和装置正确的是( )
 制取NH3
B .
制取NH3
B .  制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D .  制取Na2CO3
制取Na2CO3

| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与浓硝酸制取并收集纯净干燥的NO2 | 水 | 浓硫酸 |
| C | 用大理石和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 锌和稀盐酸制取并收集纯净干燥的H2 | 水 | 浓硫酸 |

选项 | Ⅲ中收集气体 | Ⅰ中试剂a、b | Ⅱ中试剂c | Ⅳ中试剂d |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和NaCl溶液 | NaOH溶液 |
C | HI | 浓硫酸与KI | 浓硫酸 | 水 |
D | H2S | FeS与稀盐酸 | 浓硫酸 | 酸性KMnO4溶液 |
气体 | 方法 | |
A | Cl2 | 将浓盐酸滴入高锰酸钾固体中,用排饱和食盐水法收集 |
B | NH3 | 将浓氨水滴入NaOH固体中,用向下排空气法收集 |
C | NO2 | 将铜片加入浓硝酸中,用排水法收集 |
D | SO2 | 铜与浓硫酸混合加热,用排饱和亚硫酸氢钠溶液法收集 |

气体 | 试剂 | 制备装置 | 收集方法 | |
A | NO | Cu+稀HNO3 | b | c |
B | NH3 | NH4Cl | a | d |
C | O2 | 过氧化氢溶液+MnO2 | b | e |
D | Cl2 | MnO2+浓盐酸 | b | c |
选项 | a | b | 气体 | 装置 |
A | 稀硝酸 | Cu | NO |
|
B | 稀硫酸 | 大理石 | CO2 | |
C | 浓氨水 | 生石灰 | NH3 | |
D | 浓硫酸 | Na2SO3 | SO2 |


气体 | 制备试剂 | 烧杯中试剂 | |
A | NO2 | 铜与浓硝酸 | NaOH溶液 |
B | NH3 | 浓氨水与碱石灰 | 水 |
C | C2H2 | 电石与水 | 水 |
D | Cl2 | MnO2与浓盐酸 | 饱和NaCl溶液 |
 制CO2
B .
制CO2
B .  净化CO2
C .
净化CO2
C .  制取并收集NH3
D .
制取并收集NH3
D .  制CaCO3
制CaCO3
 B . 吸收尾气中的二氧化硫
B . 吸收尾气中的二氧化硫  C . 溶解反应后烧瓶内混合物中的硫酸铜固体
C . 溶解反应后烧瓶内混合物中的硫酸铜固体  D . 加热硫酸铜溶液制备胆矾
D . 加热硫酸铜溶液制备胆矾 
 制取二氧化硫
B .
制取二氧化硫
B .  溶解反应后烧瓶内溶液中的硫酸铜固体
C .
溶解反应后烧瓶内溶液中的硫酸铜固体
C .  吸收尾气中的二氧化硫
D .
吸收尾气中的二氧化硫
D .  加热硫酸铜溶液制备硫酸铜固体
加热硫酸铜溶液制备硫酸铜固体
 B . 干燥NH3
B . 干燥NH3  C . 收集NH3
C . 收集NH3  D . 吸收氨水
D . 吸收氨水 
 实验室用装置制取氨气
B .
实验室用装置制取氨气
B .  用装置吸收氨气,并防止倒吸
C .
用装置吸收氨气,并防止倒吸
C .  用装置稀释浓硫酸
D .
用装置稀释浓硫酸
D .  用装置除去CO2中的HCl
用装置除去CO2中的HCl

编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 固体氢氧化钠 | 浓硫酸 |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
C | SO2 | 浓硫酸 | 固体亚硫酸钠 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |

已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
装置A用于制备NH3 , 圆底烧瓶内的固体a是(填名称)。
关闭K1 , 将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3 , 继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为;酸性K2Cr2O7溶液除可以吸收NH3外,还能将H2S气体氧化成硫酸,其离子方程式为。
先通过(填实验操作名称)除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有(填序号)。
①坩埚 ②蒸发皿 ③分液漏斗 ④玻璃棒 ⑤烧杯
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则指示剂的化学式为(填序号)。
A.FeCl3 B.Fe(SCN)3 C.Fe2(SO4)3 D.Fe(NO3)3
②晶体中KSCN的质量分数为(计算结果保留三位有效数字)。

为测定得到产品中NaNO2的纯度,采取如下实验步骤:准确称取质量为1.00g的NaNO2样品放入锥形瓶中,加适量水溶解后,加入过量的0.800mol·L-1KI溶液、淀粉溶液;然后滴加稀硫酸充分反应后,用0.500mol·L-1Na2S2O3溶液滴定至终点,读数,重复以上操作,3次所消耗Na2S2O3溶液的体积分别为20.02mL、19.98mL、20.25 mL。滴定终点时的实验现象,该样品中NaNO2纯度为(保留一位小数)。

通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq) Na2S2O3(aq)
写出A中的化学反应方程式。
常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是。
用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
部分反应的离子方程式为:① Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O
② I2+2S2O32-=S4O62-+2I-
滴定时Na2S2O3标准溶液应该用(填仪器名称) 盛装,该废水中Ba2+的物质的量浓度为。
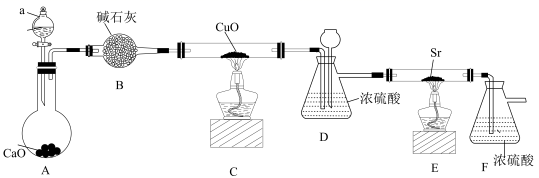

要将 c中溶液流入d,操作的方法是;

已知:Cu(NO3)2·3H2OCu(NO3)2·Cu(OH)2
CuO,SOCl2的熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
虚线框中整个装置的作用是。