下列说法错误的是( )




下列叙述错误的是( )
实验目的 | 实验操作 | |
A | 配制 Na2S 溶液 | 将 Na2S 固体加入适量 NaOH 溶液,搅拌 |
B | 除去MgCl2溶液中的Fe2+杂质 | 加入H2O2 , 再加入 MgO,搅拌、静置、过滤 |
C | 测定 NaHCO3溶液的浓度 | 用标准 HCl 溶液滴定 NaHCO3溶液,用甲基橙作指示剂 |
D | 证明2Fe3++2I- | 将浓度均为 0.1mol/L 的硫酸铁溶液和 KI 溶液等体积混合, 充分反应后再滴加数滴 KSCN 溶液,振荡 |

已知:常温下,;
;
。离子浓度小于10-5时,可认为沉淀完全,下列说法错误的是( )
已知:①SO2(g)+Cl2(g)=SO2Cl2(l)ΔH<0
②硫酰氯熔点为-54.1℃,沸点为69.1℃,易水解,100℃以上分解生成二氧化硫和氯气。
下列说法错误的是( )


下列说法正确的是( )
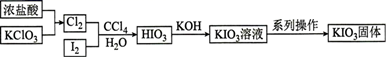


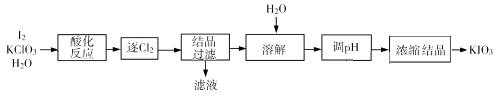
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是。“滤液”中的溶质主要是。“调pH”中发生反应的化学方程式为。
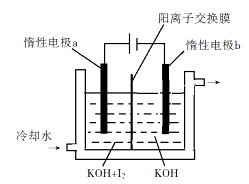
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为,其迁移方向是。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有(写出一点)。
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | ﹣69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | ﹣ | 微溶 | 难溶 | |
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行.
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣220.9kJ•mol﹣1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:.
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的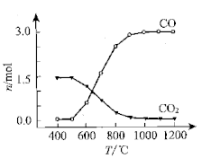
△H0(填“>”“<”或“=”),判断依据:.
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是.
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有.
精制过程:粗TiCl4经两步蒸馏得纯TiCl4 . 示意图如下:
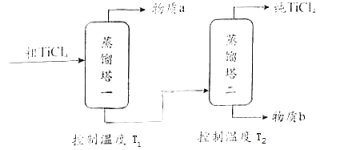
物质a是,T2应控制在.
有关物质的溶解度如图所示.
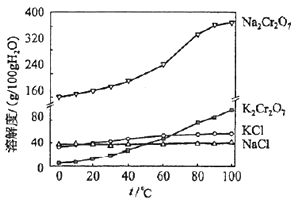
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是.
B . [实验化学]
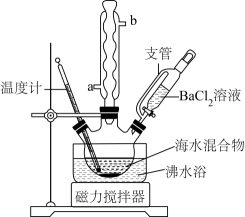
1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm﹣3 . 实验室制备少量1﹣溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr.
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止.

步骤3:将馏出液转入分液漏斗,分出有机相.
步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷.
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2•3H2O,该反应的化学方程式为.
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M'的化学式为.

①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000mol•L﹣1的EDTA(Na2H2Y•2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
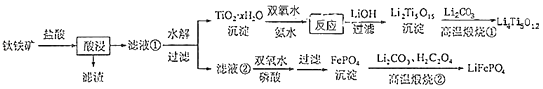
回答下列问题:
“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为.
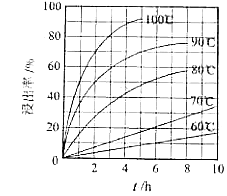
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2•xH2O转化率最高的原因.
KAl(SO4)2•12H2O(明矾)是一种复盐,在造纸等方面应用广泛.实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示.回答下列问题:![]()
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液

①下列物质可代替高氯酸的是(填序号)。
A.硫酸 B.盐酸 C.硝酸 D.磷酸
②装置b中产生的水蒸气的作用是。

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Cd(OH)2 |
Ksp | 2.6×10-39 | 4.9×10-17 | 5.9×10-15 | 1.6× 10-44 | 7.2× 10-15 |
回答下列问题:
①氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为。
②“沉渣”的主要成分除MnO2外还有。
③“氧化”时,若加入过量的Na2S2O8 , 钴元素将会进入“沉渣”中,则水解后的溶液中含钴微粒的浓度为mol·L-1。
①产生大量气体的原因是。
②ZnCO3·2Zn(OH)2·H2O需洗涤,检验是否洗净的试剂是。

离子 | Cl- | Na+ | Mg2+ | SO | Ca2+ | K+ |
浓度(×10-3mol/L) | 546 | 468 | 53.3 | 28.1 | 10.4 | 9.97 |
回答下列问题。
A.Ba(OH)2比较贵
B.Ba(OH)2的溶解度比较低
C.Ba(OH)2属于二元强碱
D.SO恰好沉淀完全时,Mg2+不能完全沉淀


t/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
-1gKsp | 1.44 | 1.53 | 1.63 | 1.71 | 1.80 | 1.90 | 2.00 | 2.21 | 2.43 |
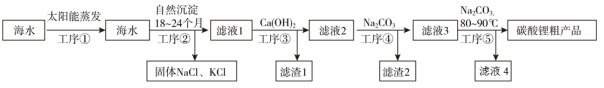
由此可知碳酸锂在水中的溶解热效应ΔH0(填“>”或者“<”);加入纯碱试剂进行“沉锂”后,依次进行保温静置、(填写正确的顺序)。
①洗涤 ②趁热过滤 ③离心分离

已知:[PbCl4]2-(aq)PbCl2(s)+2Cl-(aq) ΔH<0
回答下列问题:

已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4溶液氧化成NO , MnO
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2; S2O能把I2还原为I-。
可供选择的试剂有: A.稀硫酸 B.稀硝酸 C.c1mol·L-1KI溶液 D.淀粉溶液 E. c2mol·L -1Na2S2O3溶液 F. c3 mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,须选用的试剂是 (填序号),滴定终点的现象为。
②利用NaNO2的氧化性来测定其纯度,须选用的试剂有 (填序号)。
步骤Ⅰ:将足量废铁屑和 1.0 mol·L-1硫酸充分反应后,再与1.0 mol·L-1NH4HCO3溶液混合,装置如图1,反应结束后过滤并洗涤得FeCO3
步骤Ⅱ :将FeCO3溶于甘氨酸和柠檬酸的混合溶液,生成(NH2CH2COO)2Fe.当溶液中Fe(Ⅱ)浓度为0.5 mol·L-1时,(NH2CH2COO)2Fe产率随溶液pH的变化如图2所示。
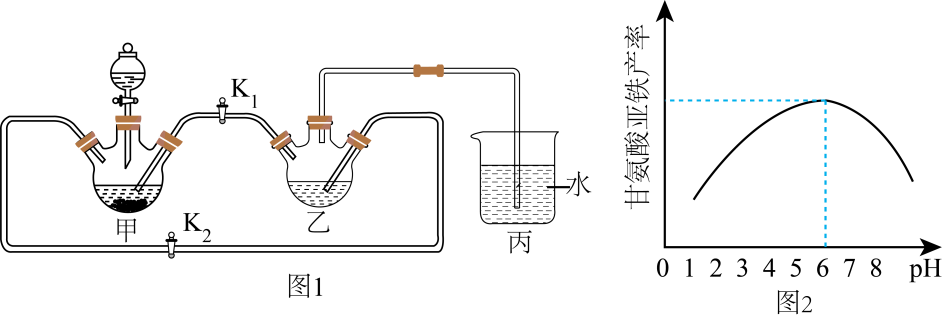
已知:①甘氨酸亚铁易溶于水,难溶于酒精;②甘氨酸具有两性,易溶于水;③柠檬酸易溶于水和酒精,具有强酸性和强还原性。

已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。

①向A装置中通入空气的作用除搅拌外还有。
②若镍粉过量,判断反应完成的现象是。
①沉淀反应的离子方程式为。
②检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是。


①仪器X的名称为,干燥管中盛装的试剂为。
②N2H4的电子式为。
③反应过程中,如果分液漏斗中溶液滴速过快,部分N2H4·H2O与NaClO反应产生大量氮气,该化学反应方程式为。
④蒸馏获得水合肼粗品后,剩余溶液进一步处理还可获得副产品NaCl和Na2CO3 , NaCl和Na2CO3的溶解度曲线如图2所示。获得NaCl粗品的操作是、 、洗涤、干燥。

①滴定时,碘的标准溶液盛放在 (填 “酸式”或“碱式”)滴定管中。
②实验测得消耗I2溶液的体积为18.00 mL,馏分中N2H4·H2O的质量分数为。 (已知:N2H4·H2O +2I2=N2 ↑+ 4HI+H2O)